Metabolik sendromun; insülin direnci, obezite, dislipidemi, endotelyal disfonksiyon, hiperkoagülasyon ve hipertansiyonun eşlik ettiği, temelinde genetik ve çevresel faktörlerin rol oynadığı kompleks bir dizi inflamasyonu kapsadığı ve gittikçe artan sıklıkta görülen sağlık problemlerinden biri olduğu bilinmektedir
15.
Son zamanlarda diyetle alınan fruktozun, obezite ve MetS komponentlerine neden olan çevresel faktörlerden biri olduğu düşünülmektedir16. Yüksek fruktoz tüketimi ile MetS modeli oluşturulabilmektedir. Bu model, farelerde hipertansiyon, hipertrigliseridemi, hiperinsülinemi ve insulin direnci meydana getirebilmektedir17. Bu amaçla, çalışmada fruktoz aracılı MetS modeli oluşturmak amacıyla, ratlara 60 gün boyunca %20 fruktoz içeren içme suyunu gavaj yolu ile uygulandı.
Deney süresince grupların ağırlık değişimleri ile serum trigliserid, glukoz, insülin ve HOMA-IR düzeyleri metabolik sendrom oluşumunu belirlemek için ölçüldü. Deneyin başlangıcında ve sonunda ölçülen ağırlık artışları değerlendirildiğinde, kontrol grubuna göre MetS grubunda artış olduğu tespit edildi. Ayrıca serum trigliserid, glukoz, insülin ve insülin direnci göstergesi olan HOMA-IR değerlerinin de kontrol grubuna göre MetS grubunda arttığı saptandı. Bu sonuçlara dayanarak da metabolik sendromun oluştuğu kanaatine varıldı17.
MetS sonucu ortaya çıkan oksidatif strese bağlı olarak testiküler dokuda hasar meydana gelmektedir. Oksidatif stres, spermatozoa fonksiyonunu azaltan en önemli faktörlerden biridir4. Sperm plazma membranı doymamış yağ asitlerinden zengindir ve bu nedenle peroksidatif hasara çok yatkındır. Bu hasar sonucu sperm hücre fonksiyonu bozulmakta ve spermotozoa motilitesi azalmaktadır18. Yağ asitleri erkek üreme hücrelerinde sperm fonksiyonlarının sağlanmasında çok önemlidir18. Yüksek metabolizma oranı ve hücre turnover değişiminin olduğu testis dokusunda oksidatif stres hasara neden olmaktadır. Buna ilaveten çoklu doymamış yağ asitlerinden zengin testiküler hücre membranları oksidatif stresten etkilenmekte ve sperm fonksiyonları bozularak infertilite oluşmaktadır19. Kısacası oksidatif stres sonucu oluşan serbest oksijen radikalleri testiküler disfonksiyona neden olarak infertilite oluşturmakta ve yapılan çalışmalar testiste oluşan oksidatif hasar ve testiküler disfonksiyon ile infertilite oluşması arasında kuvvetli bir ilişki olduğunu göstermektedir20,21.
Sağlıklı bireylerle karşılaştırıldığında MetS'lu erkeklerde serum testosteron seviyelerinin de anlamlı ölçüde azaldığı bildirilmiştir4. Bir başka araştırmada düşük testosteron seviyesinin tip II diyabet ve MetS için önemli bir belirteç olduğu ortaya konulmuştur22.
Bununla birlikte testosteron seviyesindeki düşüklük, döngüde bozukluğa yol açarak artan yağ birikimine neden olmaktadır. Kas kütlesinin azalması, insülin direncinde artış, dislipidemi ve buna bağlı oksidatif stres sonucu yağ hücrelerinde trigliserid alımını düzenleyen temel enzim olan lipoprotein lipaz aktivitesinde artış ile birlikte abdominal bölgede yağ birikimine neden olmaktadır. Bu durum da MetS'e zemin hazırlamaktadır23.
Son yıllarda MetS ve testiküler fonksiyon arasındaki ilişkide ghrelinin çok önemli rolü olduğu bildirilmiştir10. Ghrelinin yaygın doku dağılımın önemi henüz tam olarak anlaşılamamış olmakla birlikte, erkekte testiküler fonksiyonlarda da önemli rollere sahip olabileceği düşünülmektedir9,24.
Ghrelinin gıda alımı ve enerji dengesinin sağlanması yanında, glukoz metabolizması ve MetS ile ilişkili olduğu bildirilmiştir. Ghrelin konsantrasyonu obezite, Tip-2 diyabet ve diğer metabolik bozukluklar gibi farklı patofizyolojik durumlarda azalmaktadır. Plazma ghrelin konsantrasyonunun obezlerde düştüğü gösterilmiştir. Düşük ghrelin konsantrasyonun MetS prevelansıyla ve MetS'nin birçok komponenti ile yüksek oranda ilişkili olduğu tespit edilmiştir25. Yüksek vücut kitle indeksi olanlarda ghrelin düzeyi düşük bulunmuştur. Metabolik sendromlu obezlerde plazma ghrelin konsantrasyonun, non-obezlere göre daha düşük olduğu tespit edilmiştir26,27. Ayrıca insülin direnci olanlarda ve obez polikistik oversendromu olanlarda da ghrelin konsantrasyonunun düştüğü tespit edilmiştir28,29. Bunun yanı sıra kilo kaybının obezlerde ghrelin konsantrasyonunu arttırdığı gösterilmektedir30. Bu durum insülinin ghrelin sekresyonunu inhibe ettiğini göstermektedir. İnsülin ve HOMA-IR düzeyleri total ghrelin konsantrasyonu ile negatif ilişkilidir31.
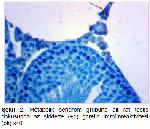
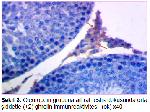
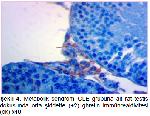
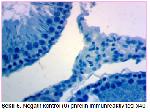
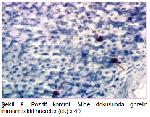
Yapılan çalışmalara uyumlu bir şekilde bu çalışmada da fruktoz ile MetS oluşturulan ratlarda testis ghrelin immünreaktivitesinin azaldığı belirlendi. Buna karşılık oleuropein uygulamasının, MetS grubundaki ratların testis dokularında ghrelin immünreaktivitesini arttırdığı tespit edildi. Ayrıca çalışmada insülin ve HOMA-IR değerlerinin MetS grubunda artması ve MetS+OLE grubunda azalması da; insülin, HOMA-IR değerleri ile testis ghrelin immunoreaktivitesi arasında negatif ilişki olduğunu desteklemektedir.
Oleuropein zeytin ve zeytin ağacı yaprağında bulunan, güçlü hipotansif, hipoglisemik ve antioksidan polifenolik bir ajan olarak tanımlanmaktadır32. Lipid peroksidasyonundan koruyucu, lipid profilini ve endotelyal fonksiyonları düzeltici olarak da etkileri vardır. Oleuropein, süperoksit anyonları ve hidroksil radikallerini süpürerek oksidatif stresi inbibe etmektedir33.
Alirezaei ve ark.34 yaptıkları çalışmada etanol ile oluşan oksidatif stresin testiküler hasara bağlı infertiliteyeyol açtığını göstermişlerdir. Oleouropeinin antioksidan etkisine bağlı olarak oksidatif stresin baskılandığı, testiküler oksidatif hasarın önlendiği, lipid peroksidasyonunun azaldığı, total sperm motilitesinin arttığı belirlenmiştir.
Bu sonuçlar, bu çalışmanın bulguları ile uygunluk göstermektedir. Çalışmanın bulguları değerlendirildiğinde testis dokusu MDA düzeylerinin MetS grubunda, kontrol grubuna göre anlamlı artış gösterdiği, katalaz aktivitesinin ise metabolik sendrom grubunda azaldığı tespit edildi. Oleuropein uygulamasının ise MetS'de artan MDA seviyesini ve azalan katalaz aktivitesini iyileştirici etkisinin olduğu tespit edildi. Ayrıca, metabolik sendrom grubundaki ratların testis dokusunda ghrelin ekspresyonunun azaldığı, oleuropein uygulanmasının ise testis dokusunda ghrelin ekspresyonunu arttırdığı belirlendi.
Bu bulgular, birçok yararlı etkiye sahip olduğu bilinen oleuropeinin, MetS'de kullanımının ghrelin düzeyini artırarak, antioksidan savunma sistemlerini aktive ederek ve lipit peroksidasyonunu engelleyerek, testis dokusunu oksidatif stresten koruduğunu göstermektedir. Sonuç olarak, MetS oluşum sürecinde bu dozda ve sürede OLE uygulamasının, rat testis dokusu üzerinde oksidatif strese karşı koruyucu etkilerinin olabileceği kanaatine varılmaktadır.