Ortopedinin önemli problemlerinden biri olan kemik defektlerinin onarımında kullanılan kemik greftlerinin yeni kemik oluşumundan sonra rezorbe olması ve yeni kemik oluşumunu arttırarak yerini yeni kemiğe bırakması tercih edilmektedir
6,12. Bu amaçla kemik greftleri ile ilgili çalışmalar halen devam etmektedir
8,12-14.
Biyoaktif camın antibakteriyel ve hemostatik özelliklerinin kemikleşme üzerinde hızlandırıcı etkisinin olabileceği 2, enfekte dokuda bakteri artışını durdurduğu, kasten enfekte edilen olgularda bile kimyasal bağlanmanın etkilenmediği 1, cerrahi operasyonlar ve travmaya bağlı oluşan enflamatuvar yanıtı ve makrofaj aktivitesini minimalize ettiği 15 bildirilmektedir. Ayrıca yeni kemikle doğrudan bağlantı sağladığı rapor edilmiştir 2,16,17.
Mineralize kemik greftlerinin kemiğe göre daha geniş bir iç yüzey ve poroziteye, kemik ile benzer kristal yapıya, elastikiyete, kimyasal bileşime ve kalsiyum/fosfor oranına sahip olduğu belirtilmiştir 18,19. Hızlı bir rezorpsiyon ve replasman sağlamak ve otojen kemiğe alternatif sunmak amacıyla mineralize kemik grefti kullanıldığı çalışmalar bildirilmiştir 20.
DBMnin otojen kemik grefti ile aynı hatta daha fazla osteoindüktif olduğu, kemik defektlerinin onarımında uygun bir materyal olduğu, revaskülarizasyonu hızlandırdığı ve kırık iyileşmesini artırdığı bildirilmektedir 8,21,22. DBMnin başka bir bireyden elde edilmesi dezavantaj olmakla birlikte herhangi bir olumsuzluk rapor edilmemiştir 22.
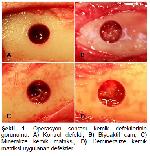
Tavşan tibia defekt modelinde defektlerin kemik diyafiz genişliğinden büyük olduğunda kırıkların meydana gelebildiği bildirilmektedir 7,12. Yapılan bu çalışmada izleme süresince herhangi bir kırık gözlenmemesi 3.5 mmlik unikortikal defektin uygun bir model olduğunu ortaya koymaktadır. Makroskopik değerlendirmelerde, kontrol defektlerinde gözlenen iyileşme yetersizliği defekt boyutlarının 2 aylık çalışma süresi için kritik büyüklükteki kemik defektleri olması ile açıklanabilir. Aynı zamanda histolojik değerlendirmelerden elde edilen bulgular da bu kanıyı güçlendirmektedir.
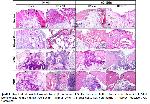
Kemik greftleri ile ilgili yapılan çalışmalarda farklı sürelerde histolojik muayeneler gerçekleştirilmiştir 12,13. Otogreft, hidroksiapatit ve yüksek derecede saflaştırılmış sığır ksenogreftinin karşılaştırıldığı bir çalışmada 23 ilk ayda trabeküler kemik oluşumunun gözlendiği, 6. ayda epifizeal yapının tamamen tamir edildiği bildirilmiştir. Kemikleşmenin 1. ve 2. haftalarda başlayıp, 6. ve 8. haftalarda ise defektlerin reorganize olduğu bilindiğinden 24, sunulan bu çalışmada histolojik muayenelerin 30. ve 60. günlerde gerçekleştirilmesi uygun bulunmuştur.
Kontrol grubunda defekt bölgesinin 30. günde fibröz doku ile doldurulması ve 60. günde ise ince trabeküler kemikle birlikte bazı olgularda fibröz dokunun hala varlığını devam ettirmesi daha önceki raporlarla 25 benzerlik göstermektedir.
Bu çalışmada biyoaktif cam grubunda greft materyaline karşı gelişen hücresel reaksiyonun hemen hemen hiç oluşmaması, biyoaktif camın enflamatuvar yanıtı ve makrofaj aktivitesini minimalize ettiğini bildiren çalışmalarla 15 uyumluluk göstermektedir. Ayrıca biyoaktif cam grubunda 30. günde belirgin greft rezorpsiyonunun gözlenmemesi, biyoaktif camların biyobozunumlarının genelde yavaş olarak gerçekleştiğini bildiren çalışmalarla da 26 paralellik göstermektedir.
Kobayashi ve ark. 27 koyunlarda L3, L4 ve L5 vertebra gövdelerinde oluşturdukları defekt modelinde biyoaktif cam, biyoaktif cam+otojen kansellöz kemik grefti ve kontrol gruplarından oluşan çalışma sonucunda her üç grup arasında da anlamlı bir farklılık gözlemediklerini bildirmişlerdir. Sunulan bu çalışmada ise Kobayashi ve ark. 27nın bildirdiklerinden farklı olarak otuzuncu günde yapılan histolojik muayenelerde biyoaktif cam uygulanan defektlerdeki iyileşmenin diğer gruplardan daha iyi olduğu anlaşılmaktadır (P<0.002). Altmışıncı gündeki histolojik değerlendirmelerde ise biyoaktif cam uygulanan defektlerdeki iyileşmenin kontrol grubu ve MBM uygulanan defektlerdeki iyileşmeye göre daha iyi olduğu gözlenirken (P<0.008), DBM grubundaki iyileşme ile benzerlik gösterdiği saptanmıştır.
MBM uygulanan defektlerde greft rezorpsiyonunun gözlenmediği 28 veya az miktarda rezorpsiyon gözlendiği 29 bildirilmektedir. Yapılan bu çalışmada ise 30 günlük histolojik incelemelerde mineralize kemik greftlerinde rezorpsiyonun oluşmadığı, 60. günde ise greft materyallerinin kısmen rezorpsiyona uğradığı gözlenmiştir.
Histolojik incelemelerde 30. günde MBM uygulanan grupta kemik defektleri sadece fibröz kallus ile doldurulmuş, tüm örneklerde 60. günde bölge tam olarak fibrositlerden zengin bağ doku ile kapanmış, kıkırdak doku oluşumu ile birlikte yer yer primer kemik doku oluşumları bulunmuştur. Bununla birlikte iyileşme bakımından MBM grubu ile kontrol ve DBM grupları arasında hem 30. günde hem de 60. günde anlamlı bir farklılık bulunamamıştır. Biyoaktif cam grubuna göre MBM grubundaki iyileşmenin hem 30. günde (P<0.002) hem de 60. günde (P<0.008) daha az gerçekleştiği gözlenmiştir.
DBM uygulanan bir çalışmada 7, 1. ayda histolojik bulgular defekt alanlarının fibröz kallus ile dolduğunu, 2. ayda ise yerini immatür kemik dokunun aldığı kaydedilmiştir. Clokie ve ark. 21 kritik boyutta kraniyal kemik defektlerini DBM ile greftlediklerinde, 6. hafta sonunda belirgin oranda kemikleşmenin ve kemik iliği oluşumunun gerçekleştiğini, 12. hafta sonunda ise büyük oranda kemik onarımının tamamlandığını bildirmişlerdir. Yapılan bu çalışmada DBM uygulanan grupların 30. gündeki histolojik kesitlerinde defekt alanlarının fibröz kallus ile dolması, kıkırdak ve çok az düzeyde yeni kemik doku oluşumlarının başlaması ve 60. gündeki histolojik kesitlerde ise defekt onarımının tam olarak şekillenmemesi literatür verilerle 7,25 benzerlik göstermektedir. DBM ile yapılan bir çalışmada 30 kranium defektlerinde uygulamasında olumlu sonuç alındığı bildirilirken, bazı çalışmalarda 7,31 ise sonuçların memnuniyet verici olmadığı bildirilmiştir.
Sunulan bu çalışmada kullanılan greft materyallerinin daha önce yapılan çalışmalardaki 7,9,13,32 gibi zamanla rezorbe edildiği, ancak tam rezorpsiyonun hiçbir greft materyalinde oluşmadığı gözlenmiştir. Bununla birlikte kullanılan greft materyallerinin yabancı cisim reaksiyonuna neden olmadığı ve yangısal bir yanıt oluşturmadığı belirlenmiştir.
Histolojik bulguların 30. ve 60. günlerde grupların kendi içlerinde yapılan karşılaştırmalarındaki farklılıklar istatistiksel olarak anlamlı bulunmuştur. Histolojik bulguların anlamlılığı kontrol, biyoaktif cam, MBM ve DBM gruplarında sırasıyla P<0.001, P<0.001, P<0.003 ve P<0.006 olarak saptanmıştır. Elde edilen veriler tüm gruplarda ilerleyen zamana bağlı olarak defektlerde oluşan kemik iyileşmesinde artış kaydedildiğini göstermektedir. Bu çalışma 2 aylık bir in-vivo dönemi kapsadığı için oluşan değişimler bu süreçle sınırlı kalmıştır.
Sonuç olarak, elde edilen bulguların genel değerlendirmesi yapıldığında, kemik defektlerinin iyileşmesinin hızlandırılmasında biyoaktif camın iyi bir greft materyali olduğu kanısına varılmıştır. Bununla birlikte kullanılan greft materyallerinin tamamen rezorpsiyonunun gerçekleşebileceği daha uzun süreli in-vivo çalışmaların yapılması ile bu greft materyallerinin uzun dönemdeki kemik iyileşmesine olan katkılarının daha iyi anlaşılabileceği düşünülmektedir.