Kullanılan Deney Hayvanları: Deneyde ağırlıkları 250-300 g, yaşları 10-12 haftalık olan erkek Spraque Dawley cinsi rat kullanıldı. Hayvanlar 24-25 °C sabit sıcaklık ve oniki saatlik karanlık aydınlık siklüsü (07:0019:00 aydınlık; 19:0007:00 karanlık) sağlanarak kontrollü bir odada, kafeslerde tutuldu. Deneme öncesinde ratların 7 gün süreyle ortama adaptasyonları sağlandı. Hayvanlara yem ve su ad libitum olarak verildi. Bu çalışma Atatürk Üniversitesi Rektörlüğü Hayvan Deneyleri Yerel Etik Kurulu Başkanlığı tarafından onaylandı (Karar No: 132/2019).
Çalışmada Kullanılan İlaçlar
Dosetaksel (DTX): Çalışmada DTX kaynağı olarak doxitax (80mg/4 mL, Koçak Farma) kullanıldı. Verilen doz literatürde belirtildiği şekilde uygulandı 9.
Silimarin (SLM): Çalışmada kullanılan antioksidan SLM Sigma‐Aldrich firmasından temin edildi. Çalışmada kullanılmış olan doz literatürde belirtildiği şekilde uygulandı 10.
Deneysel Uygulamalar: Çalışma her bir grupta Spraque Dawley cinsi 7 adet erkek rat bulunan 5 farklı gruptan oluşmaktadır. Gruplar şu şekilde dizayn edilmiştir.
1. Kontrol Grubu: 7 gün boyunca oral yolla ve sadece 1 gün 1 mL intraperitonel (i.p) olarak serum fizyolojik verildi.
2. Silimarin 50 Grubu (SLM50): 7 gün boyunca 50 mg/kg oral yolla SLM verildi.
3. Dosetaksel Grubu (DTX): 1. gün 30 mg/kg DTX tek doz i.p olarak verildi.
4. Dosetaksel + Silimarin 25 Grubu (DTX+SLM25): 1. gün 30 mg/kg dozda DTX tek doz i.p uygulanmasından 30 dk. sonra 7 gün süre ile SLM 25 mg/kg/gün dozunda oral olarak verildi.
5. Dosetaksel + Silimarin 50 Grubu (DTX+SLM50): 1. gün 30 mg/kg DTX tek doz i.p uygulanmasından 30 dk. sonra 7 gün süre ile SLM 50 mg/kg/gün dozunda oral olarak verildi.
Numunelerin Alınması: Son SLM uygulamasından 24 saat sonra (8. gün) ratlar sevofloran anestezisi altında dekapite edildi ve testis dokuları alınarak gen ekspresyonu ve biyokimyasal analizler yapılıncaya kadar 80 °Cde muhafaza edildi. Alınan testis dokuları sıvı azot kullanılarak TissueLyser II (Qiagen)de öğütüldü. Yapılan analizler öncesinde testis dokularından gerekli olan miktarlarda tartıldı ve metodlarda belirtilen tamponlar ile sulandırılarak TissueLyser II (Qiagen) ile homojenizasyon yapıldı.
Biyokimyasal Analizler: Testis homojenatlarında MDA ölçümü Placer ve ark. 11nın, GSH düzeyleri Sedlak ve Lindsay 12in, GPx aktivitesinin ölçümü Matkovics 13in , SOD aktivitesinin ölçümü Sun ve ark. 14nın, KAT aktivitesi Aebinin metoduna göre spektrofotometrik olarak ölçüldü 15. Homojenattaki protein konsantrasyonu, Lowry ve ark 16.nın metoduna göre belirlendi.
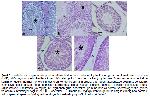
Histopatolojik İnceleme: Histopatolojik testler standart laboratuvar prosedürleri uygulanarak gerçekleştirildi. Ratlardan alınan testis dokuları 24 saat boyunca %10luk tamponlu formaldehit solüsyonunda tespit edildi. Fiksasyondan sonra testisler akan su ile formaldehitten arındırıldı ve rutin alkol-ksilol aşamasından sonra parafin bloklara gömüldü, daha sonra 5 μ kalınlıkta kesitler normal ve polilizinli lamlara alındı. Normal lam üzerine alınan dokulara hematoksilen-eozin (HE) boyama uygulandı. Son olarak, testislerde gözlenen histopatolojik değişiklikler ışık mikroskobu altında incelendi (Zeiss, AX10 Scope A1, Almanya).
İmmunhistokimyasal Boyama: Polilizinli lam üzerine 5 μ kalınlığında alınan kesitler, 57 °C'de 1 saat boyunca etüvde bekletildi. Ksilol ve alkol uygulamalarında sonra kesitler 5 dk boyunca distile suda bekletildi. Dokular endojen peroksidazı inaktive etmek için %0.3lük H2O2 solüsyonunda bekletildikten sonra antijen retrieval aşaması için sodyum sitrat solüsyonu ile 10 dk yüksek sıcaklıktaki bir mikrodalga fırında ısıtıldı. Dokular oda sıcaklığında 20 dk soğutulduktan sonra, spesifik olmayan boyanmaları önlemek amacıyla 10 dk boyunca protein blok solüsyonunda bekletildi. Dokular daha sonra primer antikor ile (Caspase-3, Santa Cruz Biotechnology, Katalog no: sc-56053, dilusyon oranı 1:100) 30 dk süreyle inkübe edildi. PBS ile yıkamadan sonra, dokulara sekonder antikor (Mouse and Rabbit Specific HRP/DAB IHC Detection Kit, ab 236466, Abcam) üretici firmanın belirtmiş olduğu şekilde uygulandı. Daha sonra DAB kromojeni ile boyanmalar görünür hale getirildi ve Mayers hematoksilen ile zıt boyandı. Kesitler entellan ile kaplandı ve ışık mikroskobu altında immunpozitiflikler pozitifliğin yoğunluğuna göre yok: 0, zayıf: 1, orta: 2, yoğun boyanma: 3 şeklinde incelendi (Zeiss, AX10 Scope A1, Almanya).
Total RNA İzolasyonu: Deneysel gruplardaki ratlardan elde edilen testis dokularından Trizol kullanılarak total RNA izolasyonu yapıldı. Bu işlem kitin prosedürüne uygun olarak yapıldı. Total RNA izolasyonunda sonra RNA konsantrasyonu spektrofotometre ile ölçüldü. Total RNA kalitesini kontrol etmek amacıyla RNAlar %1.5lik agaroz jel de 1XTBE solusyonu içerisinde 80 voltta bir saat yürütüldü ve jel görüntüleme sistemi ile görüntülenerek RNA kalitesi belirlendi.
Primer Dizayn: Apoptozis ile ilişkili olan kaspaz 8 ve 9 genlerine ait ekspresyon seviyelerinin Real Time PCR ile ölçülebilmesi için gerekli primer dizileri http://bioinfo.ut.ee/primer3-0.4.0/ ilgili linkindeki Primer Design-3 programı kullanılarak tasarlandı. Tasarlanan primer dizileri daha önce herhangi bir çalışmada kullanılmamıştır. Dolayısıyla bu çalışmanın araştırmacıları tarafından özel olarak tasarlanmıştır.
DNaz I Uygulaması ve cDNA çevrimi: İzole edilen RNA örneklerinde DNA kontaminasyonuna karşı DNaz I (Thermo Scientific) kullanıldı. Dnaz I uygulaması kitte verilen protokole uygun olarak yapıldı. Daha sonra bu RNAlardan 2-5 µg alındı ve miScript Reverse Transcription Kiti (Qiagen) verilen protokole uygun şekilde kullanılarak cDNA sentezlendi. Elde edilen cDNAnın saflığı ve miktarı spektrofotometrede yapılan 260-280 nm absorbans ölçümleri ile belirlendi ve cDNAlar aynı oranlarda sulandırıldı. Daha sonra Real Time PCR çalışmalarında kullanılmak üzere 20 °C de muhafaza edildi.
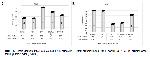
Real Time PCR: Kaspaz 8 ve 9 genlerinin mRNA transkript seviyelerini ölçmek amacıyla Qiagen Rotor Gene HRM marka cihaz kullanılarak qRT-PCR yapıldı. İnternal kontrol olarak GAPDH geni kullanıldı. Real time PCR deneylerinde oluşturulan master mix içeriği; Syber Green 2X Rox Dye Master mix (Qiagen), genler için tasarlanmış forward ve reverse primerler, template olarak cDNAlar ve nükleaz free su master mixler hazırlandıktan sonra örnekler Real Time cihazında analiz edildi ve elde edilen Ct değeleri 2-DeltaDeltaCt metoduna uygun olarak hesaplanarak ilgili genlerin ekspresyon seviyeleri belirlendi 17. Genlerin reaksiyon koşulları ve primer dizileri Tablo 1de gösterilmiştir.
İstatistiksel Analiz: Çalışmadan elde edilen tüm verilerin istatistiksel analizi SPSS 20.0 yazılımı kullanılarak yapıldı. İstatistiksel farklılıklar ve anlamlılık düzeyleri tek yönlü varyans analizi (ANOVA) testi ile belirlenmiş olup çoklu karşılaştırmalar için Tukeys HSD testi uygulandı. P<0.05 seviyesindeki sonuçlar anlamlı kabul edildi. İmmunhistokimyasal verilerin analizi parametrik olmayan Kruskal Wallis testi ve Mann-Whitney U testi kullanıldı. Ayrıca genlere ait ekspresyon seviyeleri analiz etmede GrapPad 7.2 (California, USA) programı kullanıldı.