Kontrasepsiyon gebe kalmanın önlenmesi, istenmeyen gebeliklerin sonlandırılması, dolayısıyla üremenin engellenmesi amacıyla uygulanan her türlü yöntemi kapsayan genel bir tanımdır
1. Tüm kontraseptif çalışmalar incelendiğinde medikal ve cerrahi uygulamalar olmak üzere iki ana yaklaşım olduğu görülmektedir
2,3. Cerrahi kontrasepsiyon uygulamaları dişi hayvanlarda açık/laparoskopik yolla gerçekleştirilen ovaryohisterektomi, ovarektomi, salpingektomi ve histerektomi operasyonlarını içermektedir. Erkek hayvanlarda ise kastrasyon operasyonu açık veya kapalı şekilde testislerin uzaklaştırılması esasına dayanır. Bu tür operasyonlar anestezi başta olmak üzere çeşitli perioperatif komplikasyon riski taşır. Bununla birlikte kalıcı steriliteye sebep olmaları nedeniyle hayvan sahipleri tarafından tercih edilmeme durumu sözkonusudur
2.
Medikal kontraseptif yöntemler fiziksel ve kimyasal uygulamalar olarak iki ana başlıkta değerlendirilmektedir. Fiziksel yaklaşımda bariyer metotları uygulanmaktadır. Spermatoksik intravajinal aparatlar istenilen kontrasepsiyonu sağlasa da, östrus belirtilerini baskılamayacaktır ve lokal perforasyonlara neden olabilir. Örneğin intravajinal aparat yerleştirilen köpeklerin ancak %50sinde aparatın vajina içinde kalabildiği ve bu hayvanların da %25inde gebelik görüldüğü bildirilmiştir4. Kimyasal ise progestinler, androjenler, Gonadotropin Salgılatıcı Hormon (GnRH) agonist ve antagonistlerini içeren hormon sağaltımını içermektedir. Ancak bu tip hormon uygulamalarında çeşitli metabolik ve genital sistem patalojilerini uyarabilir. Örneğin kedi ve köpeklerde östrus belirtilerinin baskılanması için kullanılan progestinler pyometra ve meme neoplazilerinin görülme oranını arttırmaktadır3.
Medikal yöntemlerin içinde değerlendirilen kontraseptif aşı uygulamaları sterilizasyon için önemli bir alternatif olarak karşımıza çıkar. Kontraseptif aşılar immunokontrasepsiyon ve gen sessizleştirme/gen terapisi gibi yöntemleri barındıran geniş bir uygulama alanına sahiptir. İdeal bir kontraseptif aşıdan istenilen özellikler sterilitenin geri dönüşümlü olması ve herhangi bir koplikasyon geliştirmeksizin uzun vadede etki göstermesidir. Evcil ve vahşi hayvan türleri için bu tür aşıların kullanımında kızgınlığın baskılanıp baskılanmamasına göre değişen kullanım seçenekleri vardır. Örneğin seksüel kaynaklı saldırgan davranışların azaltılması hayvanat bahçesi, çiftlik ve pet hayvanları için istenilen bir durum olsa da, doğal yaşamdaki vahşi hayvanlarda sürü hiyerarşisinin korunması nedeniyle istenilen bir durum değildir 5.
Gen teknolojilerinin Hayvanlarda Kontraseptif Amaçlı Kullanımı
İnterferans RNA (iRNA) ya da mikro-RNA moleküllerinin keşfi ile gen ekspresyonlarının durdurulabileceği, bunun sayesinde pek çok sentez mekanizmasının engellenebileceği fikri doğmuştur. Bir hedef genin transkriptinin, sekans spesifik (diziye özgü) bir ilişki temelinde, çift zincirli RNA (dsRNA) ile durdurulması olayı, RNA interferansı olarak tanımlanmaktadır. RNA interferans, çift zincirli RNAnın (dsRNA) hücreye girdiği zaman komplementer mRNA dizisinin parçalanmasına yol açması ile sonuçlanan transkripsiyon sonrası gen susturma mekanizmasıdır 6. Bu işlemin temeli, hedef mRNA zincirine komplementer bir çift zincirli iRNAnın tek zincirini kullanmaktır. Bu işlemde dsRNA, aktarıldığı hücrelerde küçük interfere edici iRNAlara parçalanır. Bunlara siRNA (small interfering RNA) denir. Olay hücre içi bir metot olup, hücrede oldukça komplike bir biyolojik regülatör makine olarak görev yapar. RNA interferans, istenmeyen yabancı genlerin elimine edilmesi ve aynı zamanda gen ekspresyonunun transkripsiyonel regülasyonunda hücrede kullanılan bir mekanizmadır. Bu mekanizma doğal bir işlem olup, canlı organizmadaki biyolojik fonksiyonu, virüs kalıtım materyali ve transpozonlar gibi hareketli genetik elementlerin istilasına karşı genomu koruyarak hücresel savunmada rol almaktır. Ayrıca ökaryotik organizmaların gelişimsel programlarının fonksiyonu için önemli olan transkripsiyon sonrası gen susturma ile gen regülasyonunda önemli rol oynamaktadır7-9.
Gen ekspresyonlarını baskılamak için kullanılacak siRNA molekülü viral vektörler aracılığı ile hedef hücreye taşınmaktadır. Genetik mühendislik çalışmaları sonucu virüs üretmek ve bu virüsün hedef hücreye gen taşıyabilmesi mümkündür. Yapılan ilk çalışmalar yaklaşık 10 yıl önce başlamış olsa da siRNA moleküllerini hedef hücreye ulaşmasına engelleyecek çok fazla sorun vardır. İnsan sağlığında bu yaklaşımın kullanılması şu anda klinik test aşamasındadır. Alnylam® gibi şirketler amiloidozis ve porfirya hastalıklarında kullanılmak üzere siRNA ilaçları üretmektedirler. Hayvan sağlığı alanında ise hemofili hastalığı bulunan köpeklerin tedavisinde kullanılmıştır ve sonuç olarak pıhtılaşma fonksiyonu normal sınırlara geldiği bildirilmiştir10,11.
Reprodüktif sistemde önemli genlerin baskılanması amacıyla iRNA yöntemi kullanılarak fertilitenin engellenmesi sağlanabilir. Gen sessizleştirme yani iRNA müdahalesinin etkili olabilmesi için üç önemli koşul vardır: baskılanacak spesifik genin tanımlanması, siRNA molekülünü hedef hücreye taşıyabilecek viral vektörün identifiye edilmesi ve son olarak hedef hücredeki bilinen geni baskılamak amacıyla siRNA molekülünün hücre içine girebilmesi gerekmektedir12.
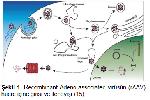
Gen sessizleştirme amacı için kullanılacak viral vektörler arasında patojenik olmayan Adeno-associated virüs (AAV) tercih edilmektedir. Rekombinant Adeno-associated virüs (rAAV) vektörlerinin güvenlik profilleri, çok sayıda insan klinik deneylerinde gösterilmiştir13. Geniş bir çeşitlilik gösteren AAV suşları spesifik dokulara tropizim gösterebilmektedirler. Ayrıca AAV kapsitleri klinik kullanım için biyolojik özelliklerini değiştirmek amacı ile genetik manipülasyonlara uygunluk sağlamaktadır14. Recombinant Adeno-associated virüsün (rAAV) hücre içine giriş mekanizmalarından bazıları Şekil 1de gösterilmiştir15. Önemli olarak, hayvan modellerinde yapılan çalışmalarda, yüksek doz intravenöz rAAV enjeksiyonu uygulandığında merkezi sinir sistemi hücrelerinin (yani kan-beyin bariyerinin ötesinde) transdüksiyonuna yol açtığını göstermiştir16-23. Yapılan bir çalışmada AAV serotip 9un modifikasyonu olan rAAVnin yetişkin fare beynine gen transferi sağlayabileceği ortaya konmuştur24.
Fertilizasyonun gerçekleşmesi için çeşitli hormonlar, gamet üretimi, folikül maturasyonu, sperm motilitesi ve aktivasyonunun yanı sıra ovulasyon, sperm ve yumurtanın füzyonu ve embriyonun implantasyonu ve gelişimine bağlıdır. Bu fizyolojik olayların her biri için gerekli olan moleküller, fertilitenin inhibe edilebileceği olası noktalar olarak Şekil 2de belirtilmiştir 25.
Şekil 2: Viral vektör kullanılarak yapılan kontraseptif yöntemlerin çeşitli hedefleri25
Günümüzde yapılan çalışmalar reprodüktif sistemde GnRHnın salgı mekanizmasını kontrol eden kisspeptin molekülü üzerine yoğunlaşmıştır. Kisspeptin hipotalamustaki KNDy sinir hücreleri tarafından salgılanmaktadır26,27. Kisspeptin, pubertal geçiş ve erişkin reprodüktif fonksiyonun devamlılığı için gereklidir 28. Kisspeptinin yanı sıra Neurokinin Bde kisspeptin ekspresyonu için gereklidir ve normal bir fertilite için her iki molekülün bulunması gerektiği bildirilmiştir29. Kisspeptin ve Neurokinin Bnin üretimlerinden sorumlu genlere bakıldığında sırasıyla Kiss1 ve Tac3 geninin sorumlu olduğu bulunmuştur 29-31. Kisspeptin ve Neurokinin B molekülleriden herhangi birisinin veya etkilediği reseptörlerin eksikliği sterilite ile sonuçlanmaktadır28,32-36.
Dissen ve ark.37, Kiss1 ve Tac3 gibi reprodüksiyonun merkezi kontrolünde yer alan genleri susturmak için Adeno-associated virüs (AAV) kullanarak bir yöntem geliştirmişlerdir. Kedilerin hipotalamusuna iletilebilen siRNA molekülünü ulaştırmayı amaçlamışlardır. Üretilen bu yapının erkek farelere enjeksiyonu sonrası 5 aylık (Çalışmanın sonu) bir sterilite gözlemlenmiştir. Daha uzun süreli baskılamayı değerlendirildiği çalışmalar da mevcuttur38-39.
Araştırmacılar ayrıca, gonadotropin inhibe edici hormon (GnIH) ve Anti-Müller hormonunun (AMH) ekspresyonunu sağlayan genlerin daha fazla üretim için etkilenebilirliğini çalışmaktadırlar. GnIHın varlığı potansiyel olarak GnRH'nın sentezini azaltabilmektedir40. Anti-Müller hormonu, Transforming Growth Faktor Beta ailesinin bir üyesidir, erkek ve dişi üreme sistemlerinde kritik bir rol oynamaktadır41-44. Erkek fetüs gelişimi sırasında Sertoli hücreleri tarafından üretilir ve başlangıçta bipotential üreme yolunda dişi Müllerian kanallarının oluşumunu bloke etmektedir. Erkeklerde AMH seviyeleri pubertaya kadar yüksek kalmakta ve daha sonra dramatik olarak azalmaktadır. Dişilerde ise AMH seviyeleri pubertaya kadar düşüktür, bu noktada erkeklerin puberta dönemi sonrasıyla karşılaştırılabilir düzeylere yükselmektedir42. Dişilerde AMH, folikül gelişmesi ve büyümesini düzenlemede kritik rol oynar. Postnatal dönemde ovaryumlardaki AMH ve buna bağlı reseptörü granüloza hücrelerinde eksprese edilmektedir. Hem işlev kaybından hem de işlev kazanma deneylerinden elde edilen kanıtlar, AMH'nın follikülogenesizde, primordial foliküllerin büyümekte olan folikül havuzuna girmesini engellediğini göstermektedir. AMH ayrıca, FSH'ya bağlı folikül büyümesini de inhibe edebilmektedir43,44. Bu gözlemler eşliğinde, AMHnın dişilerde kontraseptif amaçla kullanımı ilginç bir seçim olarak karşımıza çıkmaktadır25. Memeli hayvanların yaşam süresi boyunca yeterince yüksek AMH ifade edebilecek bir genin dişilerde foliküler gelişimi baskılayabileceğini ve sterilitesine neden olarabileceği varsayılmaktadır12. Kemoterapi gören kadınlarda folikül rezervlerini korumak adına AMH aracılı kontrasepsiyon yapılabileceği fikri araştırılmaktadır, deney hayvanları üzerinde yapılan ilk çalışmalar bunu destekler niteliktedir39.Gen terapisi ayrıca anti-GnRH monoklonal antikorların ve anti-Zona Pellucida (ZP) monoklonal antikorlarının sürekli salgılanmasına neden olabilecek bir genin üretilmesi ve uygulanması için kullanılabilir. GnRHya karşı pasif bağışıklık yanıtı için GnRH'yı inaktive edebilecek şekilde yeterince yüksek antikor titresi ve afiniteye sahip bir antikorun üretilmesini gerektirmektedir. Benzer durum anti-ZP antikorları için de gerekmektedir. Araştırmacılar38 fareler üzerinde yaptıkları çalışmada AAV vektörlü aşıların hem erkek hemde dişi hayvanlarda anti-GnRH antikorlarının aşırı ekspresyonuna sebep olduğu görülmüştür. Dişi ve erkek farelerin gonadları atrofiye uğramış ve erkek farelerde testosteron ölçülemeyecek düzeye gelmiştir. Aynı çalışmada anti-ZP antikorlarının aşırı ekspresyonları sağlanmış ve dişi hayvanlarda 6 ay süren bir sterilite gözlemlenmiştir.
Güncel çalışmalar içerisinde GnRH reseptör ekspresyonunu inhibe edebilen gen sessizleştirme teknolojileri de vardır. Bu bağlamda Hipotalamustan GnRH salınımı gerçekleşse bile hipofizdeki reseptör eksikliğinde bağlı FSH ve LH salınım mekanizmasında bozulma görülebilir. Labaratuvar çalışmalarında kitosan ile konjuge edilmiş GnRH molekülünün iRNA için yeni bir taşıyıcı molekül olduğu ve hücrelerdeki GnRH reseptör ekspresyonlarını inhibe edebildiği bildirilmiştir45.
Başka bir yaklaşım ise testislerde androjen reseptörlerinin ekspresyonunu inhibe etmek için mikro-RNA teknolojisi kullanımıdır, çünkü sperm üretimi de dahil olmak üzere normal testiküler fonksiyon için androjen uyarımı gerekmektedir. Benzer bir şekilde AAV gibi viral vektörler aracılığı ile susturucu genin taşınması sağlanabilir. Sertoli hücrelerinde bulunuan androjen reseptörlerinin inhibisyonunun sağlanması ile erkek hayvanlarda sterilitenin sağlanabileceği düşünülmektedir46.