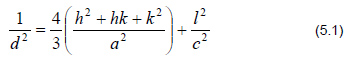Kemik doku yüksek rejenerasyon yeteneğine sahip
olmasına rağmen büyük kemik defektleri sonucunda
non-union, fibröz doku oluşumu ve pseudoartroz gibi
komplikasyonlarla karşılaşılaşılabilmektedir. Kemik
defektlerinin onarılması için otojen kemik greftleri,
biyoseramikler ve sentetik bileşikler kullanılmaktadır
1-3.
Otojen greftlerin, osteoindüktif ve osteokondüktif
özelliklere sahip olması ve vücudun reddetme ihtimalinin
olmaması sebebiyle büyük kemik defektlerinde başarı
sanşı en çok olan yöntemdir. Otojen kemik greftlerinin
dezavantajları dolayısı ile kemik defektlerinin onarımında
allogreftler, ksenogreftler, alloplastik materyallerin alternatiflerinin kullanımı olanakları araştırılmaktadır. Bu
çalışmada bu alternatiflere bir seçenek oluşturmak
amacıyla tarafımızdan üretilen HAp bir implant
materyalinin etkinliğini araştırmak amaçlandı.
Kemik dokusunda oluşan defektler, kemik
dokusuna yapılan operasyonlar sonucu her zaman
kendiliğinden iyileşmeyebilir 1,3,13. Kritik boyutlu
kemik defektleri, canlının yaşamı boyunca kendiliğinden
iyileşmeyeceği kemik defekti anlamına gelir. Kemik
dokudaki bir yaralanmanın kritik boyutta olup
olmamasını; canlının yaşı, cinsiyeti, türü, genel sağlık
durumu, defektin lokalizasyonu ve derinliği gibi etkenler
belirler. Birçok araştırmacı 10,14-16 kritik boyutlu
kemik defekti konusunda hayvan türlerine çeşitli görüşler
bildirmişlerdir. Hollinger ve ark. 17, rat kemiklerinde 8
mm çapındaki kemik defektlerinin postoperatif 13. ayda
hala kendiliğinden iyileşmediğini bildirmişlerdir. Mulliken
18, ve Glowacki 19, ratların pariyetal kemiklerinde
oluşturdukları 2 mm lik defektte 6. ayın sonunda ideal
bir iyileşme bulamadıklarını bildirmişlerdir. El-Rashidy
20, kemik iyileşmeni takiben defekt bölgesinin spontan
bırakılmasıyla bölgenin hızla bağ dokusu ile dolması
sonucunda iyileşmenin olumsuz etkileneceği bildirilmiştir.
Sergeeva ve ark. 21, birçok biyomateryallerin
osteogenezis üzerine etkilerini araştırdıkları
çalışmalarında, kemik defektlerine değişik greft
materyalleri ile boş bırakılan kontrol grubunun
postoperatif 60. gündeki histopatolojik incelemelerinde;
kontrol grubunda kemik iyileşmesinin oldukça zayıf
olduğunu ve kısmi bir fibrotik iyileşme gözlediklerini;
kemik grefti yerleştirilen gruplarda belli oranda
osteogenezisin olduğunu bildirmişlerdir. Cestari ve ark.
22 kafatasındaki 9.5 mm çapındaki defektlere sığır
kaynaklı blok greft uyguladıkları grup ile kontrol grubunu
karşılaştırmak amacıyla yaptıkları araştırmalarında; blok
greftin çevredeki yumuşak dokunun defekt bölgesine
çökmesinin engellendiği ve iyileşmenin erken döneminde
greftli grupta kontrol grubuna göre daha fazla kan
desteği sağlandığı belirlemişlerdir. Bu çalışmada da kritik
boyutlu kemik defekti oluşturmak amacıyla tibia kemiğine
2.0 mm çapında defektler oluşturuldu. Bu çalışmada da
diğer literatürleri destekleyecek şekilde, kontrol
grubunda, kemik grefti kullanılan diğer iki gruba göre
daha az yeni kemik oluşumu olduğu tespit edildi.
Yapılan bu çalışmada, defekt oluşturulan kemik
alanında Hematoksilen ve Eosin boyama yapılarak
gruplar arasında fibrozis, yabancı cisim ve primer kemik
dokusu oluşumu histopatolojik olarak değerlendirildi.
Deneysel çalışmalar 1-3,13,22 gözden geçirildiğinde
histopatolojik değerlendirme dönemlerinin farklı olduğu
görülmektedir. Kemikleşmenin 1-2. haftadan itibaren
başladığı, 6-8. haftalarda defektlerin re-organize olarak
dolduğu bildirilmektedir. Yapılan bu çalışmada olguların
postoperatif takip süresi 2 ve 4 hafta olarak seçilmiştir.
Bu konuda yapılan çalışmalar yeni kemik oluşumu ve
anjiogenezis için 4 haftalık sürenin ideal olduğu
bildirilmiştir 14,23-27. Yapılan bu çalışmada da bu
durumdan yola çıkarak çalışmayı 28. günde
sonlandırılması tercih edildi.
İdeal kemik greftlerinde oluşan defektte belirli bir
süre varlığını koruması, kemik yapımını desteklemesi, yeni kemik yapımı esnasında aşamalı olarak rezorbe olması, kemik yeterli stabiliteyi sağlaması ve kemik yapıya ulaştığında ortamda artıkları kalmaması tercih edilir 1,3,14,23-28. Hidroksiapatit malzemelerdeki in vivo etkinlik kimyasal bileşimlerine, kristal yapılarına, vücut sıvılarında stabilitesini korumasına ve rezorbsiyon karakterine bağlıdır. Kullanılmakta olan HAp kemik greftlerinin çoğu kemik içinde varlığını sürdürmekte ve kemiğin tümüyle rejenere olmasını engellemektedir. Bu durum ileri aşamalar için biyomekanik bir risk oluşturmaktadır. Hidroksiapatit greft materyallerinin kimyasal bileşimi insan kemiğinin doğal yapısı ile benzerlikler taşımaktadır. Bu greftlerin poröz yapısı ve partikül büyüklüğü rezorbe olma derecesini etkilemesine rağmen, kemikle bağlantı oluşturmasını engellememektedir. Greftlerin partikül büyüklükleri aktif rezorpsiyon mekanizmasını etkilemektedir. Mikropartiküller osteoklastlar tarafından rezorbe edilebilirken, 0.1-0.3 mmden daha büyük partiküllerin bu hücreler tarafından rezorbsiyonu azalmaktadır. 1-3 mm büyüklüğündeki partiküller ise rezorbe olmamaktadır 3,8,9,28,29 oluşumunda önemli bir etkendir. Por büyüklüğünün 300 Xmden daha büyük olduğu durumlarda yeni kapiller ve kemik oluşumu artmaktadır. Por büyüklüğünün 100 Xmden daha küçük olması durumunda greftin uygulandığı bölgeye hücreler ve kapillerler ulaşamayacağı için yeni kemik yapımı gerçekleşemez 29,30-33.
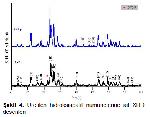
Optimum kemik rejenerasyonunun gerçeklesmesi için minimum por büyüklüğünün 200-400 Xm olması gerektiği bildirilmiştir. Yeterli damarlaşma, osteokondüksiyon ve mineralize doku oluşumunun gerçekleşmesinin ancak bu şekilde olabileceği ileri sürülmüştür. Zhang ve ark. (30)nın tavşanlarda yaptıkları bir çalışmada optimum osteokondüksiyon için por büyüklüğünün 300 Xm olması gerektiği ileri sürülmüştür. Yapılan bu çalışmada partikül büyüklüğü 0.6 mm olan, %50 poroziteye sahip HAp greft materyalleri kullanıldı.
Sonuç olarak, elde edilen histopatolojik bulgular ışığında; üretilen HAp greft materyalinin büyük kemik defektlerinin olduğu durumlarda uygulanabilirliğinin olduğu fakat bu greftlerinin rutin olarak kullanılabilirliğinin saptanması amacıyla uzun süreli ve detaylı klinik, fizyolojik, patolojik ve toksikolojik çalışmaların yapılmasının yararlı olacağı kanısına varıldı.