Ekstremitelerin en korunmasız bölümü olan tendonlar sık yaralanan dokular arasındadır. En sık yaralanmanın şekillendiği tendonlardan biri de aşil tendonudur ve çoğunlukla cerrahi teknikler kullanılarak tedavi edilir. Tendon yaralanmalarında uygulanan operatif tedavinin başarısında operatif tedavilerin tekniğine uygun ve doğru planlanması kadar postoperatif dönemdeki fizik tedavi de oldukça önemlidir. Bunun sebebi tendon ile çevre dokular arasında oluşabilecek adezyonlara bağlı hareket kısıtlanmasının önlenmesidir. Postoperatif en erken dönemde rehabilitasyon ile tendona hafif yüklemeler yapılması iyileşme süreci olumlu yönde etkilenir. Yapılan epidemiyolojik çalışmalar tendon onarımı sonrasındaki komplikasyonların sonucunda %6 sının tekrar opere edildiğini, %58inin ise tenoliz yapıldığını göstermektedir
1,3,5,14. Bu çalışmada operasyon sonrası ekstremite de herhangi bir hareket kısıtlamasına gidilmeyerek aktif olarak kullanmasına müsaade edildi. İyileşmenin olumlu neticelenmesinde bu durumun önemli rolü olduğu belirlendi.
Tendonlardaki iyileşme intrinsik ve ekstrinsik olmak üzere iki farklı mekanizma ile açıklanmıştır 1,15,16. Lu ve ark. 17 tarafından yapılan deneysel çalışmada, tendon iyileşmesinde ilk 2 haftada önemli değişikliklerin gerçekleştiği ve tüm tendonların 2 haftada olgunlaştığı; tendonlardaki organizasyonun artması ve kollajen liflerin daha homojen duruma gelmesinin ise 4 haftada oluştuğunu bildirmişlerdir. Bu sayede 4. haftada incelenen tendonların biyomekanik özellikleri, normal sağlıklı bir tendona daha yakın bulunmuştur. Yapılan bu çalışmada da tendon iyileşmelerindeki bu süreç göz önüne alınarak çalışma süresi 6 hafta olarak belirlendi. Sonuç olarak, 6 hafta sonunda tüm gruplardaki ratların tendonlarında organizasyonun şekillendiği ve kollajen liflerin daha homojen durumda olduğu, tendon rupturunun şekillenmediği fakat gruplar arasında tendonların makroskobik organizasyonları açısından farklılıklar olduğu tespit edildi.
Tendon onarımının yapıldığı bölgenin çevre dokulardan izole edilmesinin amacı, etrafındaki bağ dokudan fibroblast infiltrasyonunu engellemektir 15,18,19. Tendon çevre dokularda izole edilerek, intrinsik mekanizma ile iyileşmesi sağlanıp skar dokusu ve adezyon oluşmaması hedeflenir 1,18,20. Tendon iyileşmesi ile ilgili son yıllarda yapılan çalışmalar ekstrinsik mekanizma ile iyileşmede daha çok karşılaşılan komplikasyonları engellemeye yöneliktir 1,3,6. Tendon iyileşmesini hızlandırmak ve adezyon oluşumunu önlemek amacıyla birçok farmakolojik ajan kullanılmaktadır 1,3,5,21,22. Bu amaçla nonsteroid antiinflamatuar ilaçlar, HA, amniyotik sıvısı, kortizon, β-karoten, TGF-β inhibitörleri, vitaminler (A ve E), kollajen sentez inhibitörleri, zenginleştirilmiş kollajen solüsyonu, fibrin dolgusu, topikal β-aminopropionitril, seprafilm, politetrafloroetilen membran, amniyotik membran, hidrojel, kondroitin sülfat kaplı polihidroksietil metakrilat membran, hidroksiapatit, surfaktan, alüminyum kılıflar, silikon ve otojen ven greftleri kullanılmaktadır 1,21,22. Yapılan çalışmada kullanılan HAnın skar dokusu ve adezyonları tek dozda da olsa engellediği ancak özellikle tekrarlayan dozlarda kullanılmasının adezyon ve skar dokusu üzerine etkisinin daha iyi olduğu tespit edildi.
Tendon iyileşmesi hakkındaki verilerin çoğunluğu, deney hayvanları üzerinde yapılan çalışmalardan elde edilmiştir 5,6,16,18,20,23. Literatürler incelediğinde bu konu üzerindeki çalışmalarda rat, tavşan, sıçan ve tavuklar kullanılmıştır 5,6,18,20,24. Yapılan çalışmada, önceki çalışmalarda olduğu gibi sıklıkla tercih edilmiş olması, maliyetinin düşük olması, çalışma yapılan laboratuvarda yetiştirilme ve barınma koşullarının uygun olması gibi nedenlerden dolayı sprague dawley ırkı erkek ratlar tercih edildi.
HA, bağ dokularındaki temel bileşenidir ve birçok biyolojik fonksiyonun yerine getirilmesinde önemli rolleri vardır. Hyaluronik asit (C14H21NO11), uzun zincirli bir polisakkarittir. Bu asit, insan vücudunda bir yapıtaşı olarak, çeşitli dokularda ve eklem sıvısında bulunan mu'cizevî bir moleküldür 24-27. HA, primer tendon onarımında adezyonu oluşumunu engellemek amacıyla deneysel ve klinik pek çok çalışmada kullanılmıştır 1,22,24-27. HA, ilk olarak 1934 yılında tanımlanıp 1954 yılında kimyasal yapısı ve biyolojik fonksiyonları belirlenmiş lineer polisakkaritlerden oluşan bir glikozaminoglikandır. Erişkin ve intrauterin yara iyileşmelerinin erken dönemlerinde birikmeye başlayan ve organizmadaki tüm canlı hücrelerin ekstrasellüler alanındaki ana maddelerden biri olan HA molekülleri, yara yüzeyinde inflamasyonu azaltarak skar oluşumunu engellemesinin yanında, hızlı doku proliferasyonunda, rejenerasyonunda ve tamirinde hücre dışı matrikste yapı ve fonksiyon yönünden anahtar göreve sahiptir. HA, abdominopelvik cerrahide de sıklıkla kullanılmaktadır 1,22,24-29. Yapılan literatür taramalarında, tendon iyileşmesi ve sonrasında meydana gelen adezyon oluşumunun azaltılması üzerine tekrarlayan dozlarda HAin etkinliğinin makroskobik, biyomekanik ve histopatolojik olarak değerlendirildiği bir çalışmaya rastlanılmadı. Bu çalışmanın planlanma amacı tekrarlayan dozlarda HA kullanımının tendon iyileşmesi ve adezyon oluşması üzerine olan etkinliğini belirlemek ve bu konuda detaylı çalışmaların yapılmasını teşvik etmek amaçlandı.
Şener ve ark. 8, peritendinöz adezyonların skar formasyonundan sorumlu tuttukları TGF-β yı inhibe etmek amacıyla suramin vererek adezyon oluşumunu engellediklerini bildirmişlerdir. Özgenel ve ark. 30, amniyon sıvısının tendon iyileşmesine ve adezyon gelişimi üzerine olan etkisini araştırdıkları çalışmalarında, amnion sıvısının tendon iyileşmesinde herhangi bir olumsuzluk oluşturmadan adezyonu azalttığını bildirmişlerdir. Liu ve ark. 31, kanatlılarda fleksör tendon cerrahisi sonrası peritendinöz adezyonun gelişmesini engellemek için, amniyotik membran ve hyaluronik asidin etkisini araştırdıkları çalışmalarında; amniyotik membran ve HA kombinasyonunun adezyonu azaltmada etkili bir yöntem olduğunu ifade etmişlerdir. Yapılan bazı çalışmalarda 32,33, sodyum hyaluronatın tendon adezyonlarını azaltmada etkili olduğunu bildirmişlerdir. Yine Gaughan ve ark. 34, atların üzerinde yaptıkları çalışmada, sodyum hyaluronatın tendon iyileşmesi sırasındaki adezyonları azaltmasının yanında, inflasyon şiddetini azaltarak daha gelişmiş bir tendon yapısının oluşmasına katkıda bulunduğunu bildirmişlerdir. Alkan ve ark. 35, köpeklerde yaptığı çalışmada tendonun fasia lata otogrefti ile yapılan tamirlerinde klinik, radyografik, makroskopik ve histopatolojik değerlendirmeleri sonucunda, fascia lataın adezyonu önelemde tamirinde başarılı sonuçlar aldığımı ifade etmişlerdir.
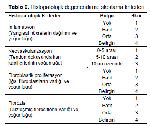
Yapılan bu çalışmada da tendon iyileşmesi ve iyileşme sırasında oluşabilecek adezyonları engellemek amacıyla HAin etkinliği makroskobik, histopatolojik ve biyomekaniksel parametreler kullanılarak değerlemesi sonucunda; kontrol grubu (Grup 1), en çok adezyon görülen grup olurken HA uygulanan Grup 2 ve Grup 3deki ratlarda adezyon şiddetinin daha az olduğu tespit edildi. Histopatolojik değerlendirmeler sonucunda neovaskülarizasyon, fibroblastik proliferasyon ve fibrozis yönünden her 3 grup arasında istatistiksel yönden anlamlı bir farklılık bulunamamasına rağmen; inflamasyon şiddeti yönünden HA uygulanan grupların kontrol grubuna göre daha az şiddette olduğu ve istatistiksel olarak farkın anlamlı olduğu tespit edildi.
Sonuç olarak, tendonların iyileşmesi ve iyileşme sırasında oluşabilecek adezyonların önlenmesinde HA uygulamalarının önemli bir alternatif olduğu kanısına varıldı. Aynı zamanda HA uygulamalarının tekrarlayan dozlarda yapılmasının daha detaylı çalışmaların yapılmasının gerekliliği tespit edildi.