İnsan ve hayvanların sağlığını olumsuz etkileyen, bağışıklığını kıran, çalışma verimini düşüren ve ölümüne neden olan parazitler, organizmada farklı doku ve organlara yerleşirler ve bundan dolayı çeşitli patojenik etkiler sonucu birbirinden farklı hastalık belirtilerinin ortaya çıkmasına neden olurlar. Günümüzde az gelişmiş ülkeler halen daha paraziter hastalıklar ile uğraşırken, gelişmiş ülkeler bilinçli ve sistemli bir şekilde yaptıkları tedavi, koruma ve kontroller ile hastalıkların çoğunu ortadan kaldırmışlar, hatta büyük bir kısmını da kontrol altına almışlardır. Buna rağmen yine de paraziter hastalıklar önemini korumaktadır, çünkü tüm önlemlere rağmen halen daha sayılarını azaltmak mümkün olmamıştır
1.
Son zamanlarda paraziter enfeksiyonların oranındaki artışa rağmen, bunların tedavisine yönelik çalışmaların sayısı, enfeksiyonların halk sağlığı üzerindeki önemli etkilerini değerlendirmek için yeterli olamamıştır. Bunun ana sebebi, bu alandaki araştırma ve geliştirmelerin, ilaç endüstrisi için ekonomik olarak etkileyici bir yanının olmamasıdır 2. Hayvancılık sektöründe özellikle büyük çiftlik işletmelerinde paraziter hastalıklar oldukça fazla görülmektedir. Uzun süreli paraziter hastalıkların varlığı, yüksek miktarlarda antiparazitik ilaç kullanımını gerektirmekte ve bu tür kemoprofilaksi ve kemoterapinin uzun bir süre boyunca uygulanması zor ve maliyetli olmakla birlikte bu durum süt, süt ürünleri ve ette ilaç kalıntıları gibi sorunlara yol açmaktadır 3. Uzun bir süre ilaç kullanımına bağlı gelişen direnç durumu geliştirilen aşıların önemli bir hale gelmesine neden olmaktadır. Bu amaçla hem moleküler biyoloji hem de genetik mühendisliği alanlarının hızla gelişmesi, aşı üretiminde yeni tekniklerin doğmasına yol açmıştır 4.
1. DNA Aşıları
Aşılar, canlıların hastalıklara karşı bağışıklık kazanmaları amacıyla geliştirilen en etkili, güvenilir biyolojik maddelerdir. Farmakolojik ilaçlara ve pestisitlerin kullanımına olan bağımlılığı azaltmada da faydalı olan bu aşılar paraziter hastalıkları kontrol etmek için alternatif çözümler olarak da düşünülmektedir. Uygulanan farklı teknolojiler ile yeni aşıların geliştirilmesi için sentetik peptidler, DNA aşıları ve rekombinant vektör aşıları umut verici seçeneklerdir 5.
1.1. Tanımı ve Özellikleri
DNA aşılaması, immünolojik bir yanıt üretmek için genetik olarak tasarlanmış olan DNA'yı kullanan yeni bir teknolojik metoddur. DNA aşıları, günümüzde gelişmekte olan bir subunit aşı türüdür. Bu tip aşıda, patojenin DNA'sının bir kısmı bir bakteriyel araç vektörüne yerleştirilir ve kas içine, deri içine veya deri altına enjekte edilir. DNA dokuya enjekte edildikten sonra bazı hücreler vektörü alır ve daha sonra çekirdeğe transloke olur ve burada kopyalanıp sanki konak DNA'sıymış gibi translasyon yapılır, üretiminin ardından oluşan protein, yabancı cisim olarak tanıtıldığı için bağışıklık sistemine sunulur. DNA aşıları, güvenlik, üretim kolaylığı, stabilite ve immünojenisite açısından diğer aşı teknolojilerine göre belirgin avantajlar sağlayan çok çeşitli özelliklere sahiptir 6,7.
Öldürülmüş veya zayıflatılmış patojenik ajanları içeren patojenlere karşı elde edilen geleneksel aşılara karşın, DNA aşıları güvenli bulunmayan bulaşıcı ajanları içermez, patojenite riski taşımaz ve her kesime güvenle uygulanabilir. Ayrıca, DNA aşıları, adoptif bağışıklığın üç kolunu oluşturan; antikorlar, yardımcı T hücreleri (Th) ve sitotoksik T-lenfositler (CTL'ler) ve ayrıca doğuştan gelen bağışıklık tepkilerini verimli bir şekilde aktive edebilirler 8. Son derece esnek genetik tasarımları ve basit yapıları nedeniyle DNA plazmidleri kısa sürede kolayca manipüle ve modifiye edilebilir. Bu durum, pandemik tehditlerin ortaya çıkmasına karşın aşı üretirken önemli bir kriterdir. DNA plazmid aşı vektörleri bakterilerde kolaylıkla kopyalanabildiği ve çoğaltılabildiği için DNA aşılarının ucuz ve önemli ölçüdeki üretimini de mümkün kılar. Diğer bir önemli avantaj ise DNA aşılarının oda sıcaklığında oldukça kararlı olmaları ve özel soğutma durumu gerektirmediklerinden kolayca saklanabilmeleri ve bu durum da onları gelişmekte olan ülkelerdeki kullanımı için çok pratik hale getirmektedir 9. Aynı zamanda, DNA aşıları son derece esnektir ve viral/bakteriyel antijenler ve immünolojik/biyolojik proteinler de dahil olmak üzere tek bir yapıdaki birden fazla proteini kodlayabilir, güçlerini artırmak için adjuvan ekleme olasılığı ile multigenler veya multivalan aşılar oluşturabilirler 10,11. DNA aşılarının olumsuzlukları ise otoimmun bozukluklara neden olma olasılığı, antibiyotik direnç geninin transfer riski, immün adjuvanlara karşı oto antikor geliştirme olasılığı, yabancı DNA'nın konakçıya entegre olması nedeniyle insersiyonel mutajeneze yol açabilmeleridir 7.
1.2. DNA Aşılarının Tasarımı
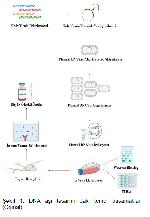
DNA aşı tasarımındaki temel basamaklar (Şekil 1) kısaca aşağıdaki gibidir;
1. İlk olarak aşı çalışmasında kullanılacak olan hedef gen bölgesi seçilir ve restriksiyon enzimleri ile kesilerek istenilen genin izolasyonu sağlanır.
2. İzole edilen hedef gen daha önce belirlenmiş olan bir plazmide yerleştirilir.
3. Hedef geni taşıyan plazmid daha sonra alıcı bir hücreye aktarılarak çoğaltılır. Böylelikle çok fazla hücre bölünmesi ile özdeş konağın bir kolonisi üretilir.
4. Çoğaltılan plazmid DNAların izolasyonu sağlanır.
5. İzole edilen plazmid DNAnın kalitatif ve semikantitatif olarak belirtilmesi için in vitro ekspresyonu yapılır.
6. Sonrasında elde edilen rekombinant aşının hayvan denemeleri ile immun yanıtları ve klinik durumları belirlenmeye çalışılır.
7. Rekombinat aşının tüm denemeleri olumlu sonuçlandığında ve patenti alındığında büyük ölçekli bir üretime gidilir.
2. Parazitoloji Alanındaki DNA Aşı Çalışmaları
2.1. Fasciola spp.
Fasciola hepatica glutatyon S-transferazı (GST) kodlayan DNA yapıları ile aşılamayı takiben farelerdeki humoral tepkiler değerlendirilmiş ve GST47 cDNA, ekspresyonu sırasıyla sitoplazmik ve hücre dışı bölümlere yönlendiren VR1012 ve VR1020 olmak üzere iki DNA aşı vektörüne klonlanmıştır. Neticede, Fasciola GST'ye dayalı bir DNA aşısının immünojenisitesinin yanı sıra GST'ye karşı yanıtın izotipinin aşı uygulama modu tarafından belirlendiği gösterilmiş ve humoral immun yanıt elde edilmiştir 12. Kofta ve ark. 13, sistein proteinaz cDNA ile aşılanan erkek sıçanların, F. hepatica enfeksiyonuna karşı %100, dişi sıçanların ise %74 oranında korunduğunu belirlemişlerdir. Başka bir çalışmada, hem F. gigantica yağ asidi bağlayıcı protein (FABP) hem de F. hepatica katepsin L5'in (FhCatL5) COS 7 hücrelerinde eksprese edildiği ve farelerde salgı yapıları olarak verildiğinde humoral bir tepkiyi indüklediği gösterilmiştir. Sonuçlar, Fasciola antijenlerinin DNA aşıları olarak kullanılabileceğini, ancak yanıtın kalitesinin antijenler arasında değiştiğini ve aşı verme yönteminden etkilendiğini göstermektedir 14. Wedrychowicz ve ark. 15, GST cDNA ile aşılanmış sıçanlarda %54 ve GST proteini ile aşılanmış grupta %48 oranında parazit yükünün azaldığını ortaya koymuşlardır. GST proteini ile aşılanmış grup, aşılamayı takiben net IgG1, IgG2a, IgG2b ve IgA tepkileri gösterirken, GST'nin cDNA'sı ile aşılanmış sıçanlarda enfeksiyondan sonraki günden sonra hiçbir spesifik antikor bulunmamıştır. Yine Wedrychowicz ve ark. 16, sistein proteinazını (CP) kodlayan cDNA (CPcDNA) ile intranazal, intramüsküler ve intraperitoneal olarak aşılanan sıçanların CPcDNA ile intranazal immünizasyonunun Th2 yanıtını, intramüsküler veya intraperitoneal enjeksiyonların ise hem Th1 hem de Th2'ye bağımlı antikorları uyardığını göstermişlerdir. Espino ve ark. 17, F. hepatica protein ailesinin saposin benzeri (FhSAP-2) yeni bir antijeninin DNA aşısı olarak verilebileceğini ve tek başına rekombinant proteinden daha güçlü bir Th1 tepkisini indüklediğini bildirmişlerdir. Espino ve ark. 18, başka bir çalışmalarında, cDNA-FhSAP2 ile aşılanmış farelerde bulunan ortalama parazit yükünün, kontrollere kıyasla %83.3, rekombinant protein ile aşılanmış farelerde ise %60 oranında azaldığını belirlemişlerdir. Tüm aşılanmış hayvanların, deneme kontrollerine göre daha az karaciğer hasarına sahip olduğu gözlenmiştir. Başka bir çalışmada ise, genç parazitler tarafından salgılanan önemli bir sistein proteaz olan Catepsin B (Cat B2)'nin bağışıklık tepkilerini artırmak için cDNA dizisi dört farklı DNA aşı vektörü ile kaynaştırılmıştır. DNA aşıları, yüksek Cat B2'ye özgü IgG, IgG1, IgE ve ayrıca orta düzeyde IgG2a antikor yanıtları ortaya çıkarırken, Cat B2'ye özgü IL-4 T hücre tepkileri, Cat B2 ile aşılanmış farelerde de gözlenmiştir 19.
2.2. Schistosoma spp.
Zhou ve ark. (20), Sjc97'yi kodlayan nükleik asidin, intramüsküler yoldan uygulandığında C57BL/6 farelerinde Th1 tipi bir bağışıklık tepkisini indükleyebildiğini ve koruyucu etkinlik sağlayabildiğini göstermektedir. Zhang ve ark. 21, S. japonicum'u kodlayan dört DNA plazmidi içeren bir kokteyl DNA aşısı kullanarak fare aşılama deneyleri gerçekleştirmişlerdir. Kokteyl DNA aşısının üç intramüsküler enjeksiyonu, rekombinant antijenlerle in vitro stimülasyon üzerine splenositler tarafından yüksek düzeyde IFN-y üretimi ile önemli bir Th1 hücresel tepkiyi indüklemiştir. Lei ve ark. 22, S. japonicum'un SjTsp2 ve Sj29 zar proteinlerini içeren yüksek performanslı iki değerlikli bir DNA aşısı üzerine çalışmışlardır. Uygulama sonucunda SjTsp2, Sj29 ve SjTsp2-29 ile aşılamanın kontrol grubuna kıyasla parazit yükünü ve karaciğer patolojisini azalttığı ve bivalan SjTsp2-29 DNA aşısının koruyucu etkisinin tek değerli SjTsp2 veya Sj29 DNA aşılarından daha iyi olduğunu göstermiştir. Frantz ve ark. 23, DNA-hsp65 aşısının fareleri Schistosoma yumurtalarının neden olduğu fibrozise karşı koruduğunu ve granülomların boyutunu azalttığını bildirmişlerdir. Chlichlia ve ark. 24, DNA bazlı aşı teknolojisini, farelerde bir şistozom sistein proteinazı olan asparaginil endopeptidaza (Sm32) karşı bir bağışıklık tepkisini indüklemek için kullanmışlardır. Bu DNA aşısı, dişi parazitlerin üreme faaliyetleri üzerinde negatif bir etkiye yol açmıştır. Enfeksiyona maruz kalan dişi parazitler, saf farelerde büyüyenlere göre %37 daha az yumurta üretmiştir. Sonuçlar, Sm32'nin şistozomlara karşı bir anti-patoloji aşısının üretilmesi için aday antijen olabileceğini düşündürmüştür.
2.3. Taenia spp.
Taenia saginatanın TSA-9 ve TSA-18 olarak adlandırılan iki antijeninin bir kombinasyonu ile aşılamanın, T. saginata ile deneysel enfeksiyona karşı %99.8'e kadar koruma sağladığı tespit edilmiştir 25. Guo ve ark. 26, iki farklı prime-boost rejiminde aşılanmış domuzlarda T. soliuma karşı koruma süresini araştırmışlardır. Sonuçlar, 6. ve 12. haftalarda enfekte edilip aşılanmış domuzların kist gelişiminde önemli azalma olduğunu göstermiştir. 20. haftada enfekte edildiğinde, DNA aşısı (pcDNA3-cC1) ve ardından protein aşısının iki güçlendiricisi (GST-cC1) ile aşılanan domuzlar, T. solium yumurtalarının tehdidine karşı önemli oranda korunurken, protein aşısının üç enjeksiyonunu alan domuzlar, aşılanmamış kontrollere kıyasla önemli bir koruma göstermemiştir. Drew ve ark. 27, üç farklı T. ovis konak koruyucu 45W, 18k ve 16k antijenlerini kodlayan DNA aşılarının immünojenisitesini, fare ve koyunlarda karşılaştırmışlardır. 45W, 18k veya 16k antijeni eksprese eden DNA aşıları, farelerde immünojenik bulunmuş ve önemli spesifik antikor titreleri üretmiştir. Yetişkin koyunların DNA aşıları ile aşılanmaları neticesinde 45W'ye özgü antikor önemli ölçüde daha düşük düzeyde üretilirken, 18k veya 16k'ya özgü antikor üretimi olmamıştır.
2.4. Echinococcus granulosus
BALB/c farelerinde adjuvan olarak murin interlökin 12 (pcMIL12) ile birlikte aşı olarak E. granulosus antijen B (pcHyd1) içeren ekspresyon plazmidi pcDNA3.1in kullanıldığı bir çalışmada, pcHydI+pcMIL12 alan fareler, tek başına pcHyd1 alan farelere kıyasla daha yüksek seviyelerde lenfosit proliferasyonu sergilemiş ve diğer gruplara kıyasla önemli ölçüde daha fazla IFN-y üretmişlerdir. IgG2a seviyeleri, pcHyd1+pcMIL12 grubunda tek başına pcHydI, boş plazmid ve PBS gruplarıyla karşılaştırıldığında açıkça daha yüksek bulunmuştur. Buna karşılık, pcHyd1 grubunda IgG1 yükselmiş ve IL-12'nin antijen B'nin 8 kDa alt birimini kodlayan DNA ile birlikte verilmesi, farelerde bağışıklık tepkisini indüklemede önemli ölçüde etkili olmuştur 28.
2.5. Haemonchus contortus
Gliseraldehit-3-fosfat dehidrojenazın (HcGAPDH) parazit fizyolojisindeki kritik işlevleri nedeniyle, H. contortus'ta aşı için potansiyel bir aday olabileceği düşünülmüş ve HcGAPDH antijenini eksprese eden DNA aşısı, keçilerde deneysel H. contortus enfeksiyonlarına karşı koruma için test edilmiştir. DNA aşısı ile bağışıklamadan sonra, önemli ölçüde yüksek seviyelerde serum IgG, serum IgA, mukozal IgA, CD4+ T lenfositleri ve B lenfositleri üretildiği gözlenmiştir. Ayrıca aşılanan grupta kan eozinofillerinin sayısında artış ve hemoglobin seviyesinde düşüş gözlenmiştir 29.
2.6. Ancylostoma ceylanicum
Ancylostoma ceylanicum metalloproteaz 6'yı (Ace-mep-6) kodlayan bir cDNA klonlanıp, hamster grupları bu DNA aşısı ile bir veya üç kez aşılanmışlardır. Tek doz uygulanan hayvanlar enfeksiyona karşı yüksek direnç geliştirirken, üçlü bağışıklama parazit yükünde azalma ile sonuçlanmamıştır 30.
2.7. Strongyloides stercoralis
Kerepesi ve ark. 31, S. stercoralis larvalarından elde edilen, tropomyosin (Sstmy-1), Na+-K+ATPase (Sseat-6) ve LEC-5 (Sslec-5) antijenlerini kodlayan genleri, fare ve sıçanlara granülosit-makrofaj koloni uyarıcı faktör içeren bir plazmid ile kombinasyon halinde intradermal olarak vermişlerdir. Sadece Na+-K+ATPase DNA ile bağışıklamadan sonra larva sayısında önemli bir azalma görülürken, Na+-K+ATPase dahil olmak üzere üç plazmidin tümünün bir kombinasyonu ile bağışıklama sonucu koruyucu bir bağışıklık indüklenememiştir.
2.8. Ascaris suum
Ascaris suum enolaz'ını (As-enol-1) kodlayan gen bölgesi amplifiye edilip klonlanlanmış, pVAX-Enol ile bağışıklanan farelerin, A. suum'a karşı yüksek düzeyde spesifik antikor tepkileri, güçlü bir lenfoproliferatif tepki ve önemli seviyelerde IFN-y, IL-2, IL-4 ve IL-10 üretimi geliştirdiği gösterilmiştir 32.
2.9. Toxocara canis
pcDNA3-CpG aşısının T. canis enfeksiyonunu takiben kalıcı ama düşük seviyelerde kan/bronko alveolar eozinofiliye yol açtığı gösterilmiştir. Bu aşı aynı zamanda, düşük IgG1 seviyelerinin yanı sıra yüksek IFN-y/IL-4 ve ardından yüksek IgG2a/IgG1 oranına yol açmıştır 33.
2.10. Brugia malayi
Li ve ark. 34, B. malayinin paramiyosin (BM5), ısı şoku proteini (BMHSP-70), ara filament (BMIF) ve bir serodiagnostik antijen (BM14) kodlayan 4 gen bölgesini ökaryotik ekspresyon vektörlerine (pJW4303 ve pCR3.1) yerleştirmişlerdir. BM5 paramiyozinine karşı antikor yanıtları, intradermal aşılamadansonra daha düşük IgG2a ve IgG1 seviyeleri gösterirken, intramüsküler aşılama baskın IgG2a antikor yanıtları üretmiştir.
2.11.Onhocerca volvulus
Steisslinger ve ark. 35, bir DNA aşı adayı olarak O. volvulus gliseraldehit-3-fosfat dehidrojenazı (Ov-GAPDH) değerlendirmişlerdir. DNA plazmidini içeren formülasyonlar, bağışık hayvanlarda erişkin parazit yüklerinde ve mikrofilaremide %94'e kadar azalmaya yol açmıştır.
2.12.Trichinella spiralis
Trichinella spiralis Ts87 geni bir ekspresyon plazmidi olan pVAX1'e klonlanmıştır. Ts87 DNA'sı ile aşılanan farelerde lokal mukozal IgA tepkisi ve sistemik bir Th1/Th2 bağışıklık tepkisi ortaya çıkmıştır. Sonuç olarak, Ts87 DNA'sının, bir IgA tepkisi ve dengeli bir Th1/Th2 bağışıklık tepkisi ortaya çıkararak farelerde T. spiralis enfeksiyonuna karşı kısmi bir koruma sağladığı gösterilmiştir 36.
2.13. Trypanasoma spp.
Trypanosoma evansi beta (β) tubulin genini kodlayan bir DNA parçası, farelerde humoral bağışıklık tepkisini ortaya çıkarmak için kullanılmıştır. Bağışıklama sonrası, IFN-y ve TNF-α seviyelerinde önemli bir artışla birlikte baskın bir T yardımcı hücre Tip 1 (Th1) tepkisi tespit edilmiştir 37. Limon-Flores ve ark. 38, T. cruzi enfeksiyonunun önlenmesi ve tedavisi amacıyla TSA-1 ve Tc24'ün bir kombinasyonunu kodlayan yeni bir DNA aşısını test etmişlerdir. Terapötik aşılama sonrası dalakta parazite özgü IFN-y üreten CD4+ ve CD8+ T hücrelerinde belirgin bir artış gözlenmiştir. Silva ve ark. 39, T. brucei brucei'nin trans-sialidaz (nTSA) genini kodlayan bir plazmid DNA aşısı ile intramüsküler yolla bağışıklanan BALB/c farelerinin, IgG antikorları üretebildiğini ve T. brucei brucei ile enfekte edilmiş farelerin %60'ının korunduğunu göstermişlerdir.
2.14. Leishmania spp.
Ahmed ve ark. 40, Leishmania majore ait LACK, PSA2, Gp63, LeIF ve p20 antijenlerinin BALB/c farelerindeki koruyucu etkilerini karşılaştırmışlardır. En iyi koruma, LACK DNA aşısı ile aşılanmış farelerde gözlenmiştir. Bununla birlikte, DNA aşısı adaylarının hiçbiri, L. major ile enfekte edilen BALB/c farelerinde tam bir koruma sağlayamamıştır. Aguilar-Be ve ark. 41, fucose-mannose ligand (FML), rekombinant nucleoside hydrolase 36 (rNH36) ve NH36 genlerini BALB/c farelerinde visseral (L. chagasi) ve kutanöz (L. mexicana) leishmaniasis etkenlerine karşı bağışıklık tepkisini test etmişlerdir. Üç aşı grubunun tümü, L. chagasiye karşı yüksek IgG, IgG1 ve IgG2a seviyeleri göstermiştir. rNH36 veya FML ile immünize edilmiş farelerde ise L. donovani ve L. mexicana antijenlerine karşı güçlü bir intradermal reaksiyon görülmüştür. L. chagasi enfeksiyonuna karşı FML ve rNH36 antijenleri ile immünize edilmiş farelerde parazit yüklerinde %79'luk bir azalma tespit edilmiştir. En iyi koruma, NH36 DNA aşısı ile aşılanmış farelerde gözlenmiştir. Sonuç olarak, NH36 DNA aşısının viseral ve kutanöz leishmaniasis'e karşı güçlü bir immün korumayı indüklediği gösterilmiştir. Oliveira-da-Silva ve ark. 42, pyridoxal kinase (PK)ın bir DNA plazmidi (pDNAA3/PK) veya rekombinant protein (rPK) olarak uygulandığında şekillenen bağışıklılık durumunu değerlendirmişlerdir. Her iki aşılama şeklinde de Th1 bağışıklık tepkilerindeki değişiklikler nedeniyle farelerde L. infantuma karşı koruma sağlanmıştır.
2.15. Giardia lamblia
Giardia lamblia'dan tam uzunlukta bir kist duvarı proteini-2yi (CWP2) kodlayan gen bölgesi klonlanmış ve S. typhimurium'a dahil edilmiştir. DNA aşısının uygulanması, Th1/Th2 tepkisi ile karakterize edilen CWP2'ye özgü hücresel bağışıklık tepkilerinin üretilmesine yol açmış, ELISA ile bağırsak salgılarında antijene özgü IgA ve IgG antikorları tespit edilmiştir. DNA aşısı uygulanan farelerden atılan kist oranında yaklaşık %60 oranında azalma olduğu görülmüştür 43.
2.16. Cryptosporidium spp.
Yu ve ark. 44, Cryptosporidium parvuma karşı oluşturulan Cp12, Cp21, Cp12-Cp21 ve C [CpG oligodeoksinükleotid (ODN)]-Cp12-Cp21'in DNA dizilerini amplifiye etmişler ve daha sonra pVAX1 vektörüne klonlayarak dört rekombinant plazmid oluşturmuşlardır. Sonuç olarak, dört DNA aşısının uygulama sonrası, önemli antikor tepkileri ve spesifik hücresel tepkiler ortaya çıkardığını göstermişlerdir. Bu dört plazmid arasında, pVAX1-C-Cp12-Cp21, önemli ölçüde daha yüksek IgG seviyeleri ortaya çıkarmıştır. Sonuç olarak, pVAX1-C-Cp12-Cp21 nazal gruptaki farelerin ookist çıkarma seviyesinde %77.5'lik bir azalmaya sahip olduğu gösterilmiştir.
2.17. Eimeria spp.
Song ve ark. 45, E. tenella, E. necatrix, E. maxima ve E. acervulina'ya karşı epitop DNA aşılarının tavuklar üzerindeki koruyucu etkilerini değerlendirmişlerdir. Yapılandırılmış bu çok değerlikli epitop DNA aşılarının, vücut ağırlığını önemli ölçüde artırdığı, enterik lezyonları hafiflettiği ve enfekte kanatlıların dışkısındaki ookist sayısını azalttığını tespit etmişlerdir.
2.18. Toxoplasma gondii
Toxoplasma gondii'ye karşı bağışıklığa CD8+ T hücreleri ve IFN-γ üretimi aracılık ediyor gibi göründüğünden 46, bu aşılar sitotoksik bir bağışıklık tepkisinin güçlü aktivatörleri olduğu için DNA aşılaması toksoplazmoza karşı uygun bir bağışıklık kazandırma aracı olabilir. Bir dizi aday antijen, tek gen formülasyonlarında kullanılmış veya çok değerlikli DNA aşılarında birleştirilmiştir. Bu yapılar, toksoplazmoza karşı değişen derecelerde kısmi koruma sağlamıştır. Seçilen genler arasında, takizoit yüzeyinde bulunan en bol protein olan yüzey antijen ailesinin üyeleri bulunmaktadır 47. İyi taranan adaylardan oluşan ikinci bir grup, takizoitlerin vakuolünün ve bradzoitlerin kist duvarının önemli bir bileşeni olan yoğun granül antijen ailesine aittir 48. Önerilen diğer antijenler, mikronem 49 ve rhoptry proteinleri 50 gibi konakçı hücre istilasının teşvik edilmesinde rol oynayan proteinleri içermektedir. AMA1 51, bradizoit antijen 1 51 ve ısı şoku proteinleri HSP70 ve HSP30'un 52 immünolojik potansiyeli de değerlendirilmiştir.
2.19. Neospora caninum
Yu ve ark. 53, BALB/c farelerinde yoğun granül proteinleri 1 (GRA1), GRA4, GRA9, GRA14, GRA17 ve GRA23'ü kodlayan genlere sahip DNA aşılarının N. caninum takizoitlerine karşı oluşturduğu koruyucu bağışıklığı değerlendirmişlerdir. Bağışıklık tepkileri, serum antikor düzeylerinin izlenmesi, lenfosit proliferasyonunun ölçülmesi ve sitokinlerin salgılanması yoluyla değerlendirilmiştir. Sonuçlar, tüm DNA aşılarının, daha yüksek seviyelerde IgG ve IgG2a antikorları ve ayrıca artan Th1 tipi IFN-γ salgılanması ile dikkat çekici ölçüde spesifik humoral ve hücresel tepkileri tetikleyebileceğini göstermiştir.
2.20. Plasmodium spp.
DNA aşıları, tek gen formülasyonları olarak uygulanabildiği gibi aynı zamanda bir antijen kombinasyonu olarak da oluşturulabilir. Bu adaylar arasında sirkumsporozoid protein (CSP), exported protein 1 (EXP1), sporozoit yüzey proteini 2 (SSP2) ve karaciğer evresi antijenleri LSA1 ve LSA3 yer alır. Bu proteinler sporozoitlerin yüzeyinde bulunur ve bu nedenle eritrosit safhası öncesi, aşılarda kullanılabilir. Kan evresi aşıları, merozoit yüzey proteini 1 (MSP1), apikal membran antijeni 1 (AMA1) ve eritrosit bağlayıcı protein (EBA-175) gibi merozoitlerin yüzeyinde bulunan antijenlere dayanır. İnsanlarda test edilen en umut verici prototiplerden biri, aynı proteini kodlayan Modified vaccinia virus Ankara (MVA) ile birlikte uygulanan thrombospondin-related adhesive protein (TRAP) antijenini kodlayan aşı prototipidir. Bu aşının kullanılması, deneysel enfeksiyonda paraziteminin başlamasını geciktirmiştir 54. Bu formülasyon ile antikorların üretiminin arttığı tespit edilmiştir. Bu aday antijen P. falciparum'a karşı gelişmiş en iyi adaylardan biri olarak kabul edilir 55,56. Bu aşının etkinliğini artırmaya yönelik stratejiler, MSP1 gibi antijenlerin kullanımı veya bir heterolog prime-boost kullanımı ile artırılabilir 57.
2.21. Babesia microti
Sistein proteaz 1 (CP1) ve Apikal Membran Antijen-1 (AMA-1) ile ayrı ayrı ve kombinasyon halinde uygulanarak DNA aşılarının koruyucu etkileri değerlendirilmiştir. Bu aşılar uygulandıktan sonra parazitin gelişiminde bir engel oluşturduğu tespit edilmiştir. Bununla birlikte, aynı anda verilen iki yapının kombinasyonunun parazit ilerlemesi üzerinde belirgin bir etkisinin olmadığı görülmüştür 58.
2.22. Anaplasma spp.
Crosby ve ark. 59, rekombinant VirB9-1, VirB9-2 ve VirB10 ile fareleri aşılayarak bağışıklık tepkilerini gözlemlemişlerdir. Anaplasma phagocytophilum Tip 4 Salgı Sistemi (T4SS) VirB10'un bir murin modelinde IFN- γ'ye bağlı bir şekilde enfeksiyona karşı kısmen koruyucu olduğuna dair kanıt sağlamıştır. Muhtemelen bir T4SS DNA aşısının diğer patojenik anaplasma türlerine karşı da potansiyel bir aşı adayı olabileceği öne sürülmüştür.
2.23. Ixodidae spp.
Klouwens ve ark. 60, bir kene ısırması enfeksiyon modelinde kene antijenlerinin etkinliklerini değerlendirmişlerdir. Kene antijenleri olan TSLPI, Salp15, tHRF ve Tix-5'e karşı düşük ile orta IgG titreleri indüklenmiş, ancak tam bir koruma sağlanamamıştır. Bu nedenle, DNA aşısı, kene karşıtı aşılar için kene antijenlerini belirlemek veya taramak için uygun bir aşı stratejisi gibi görünmemektedir. Zhang ve ark. 61 tavşanlarda Haemaphysalis longicornis Paramiyosinini (Pmy) kodlayan rekombinant plazmidlerin sağladığı bağışıklık tepkisini değerlendirmişlerdir. Pmy ile aşılanan tavşanlar, kontrol grubuna kıyasla yüksek düzeyde IgG gelişmiştir. DNA aşısı ile aşılama sonrası tavşanların immün korumasında genel olarak %50'lik bir etkinlik sağlanmıştır.
2.24. Varroa destructor
Giese ve ark. 62, bu amaçla arının bağışıklık sisteminin tam işlevini yeniden oluşturabilen DNA aşısı geliştirmişlerdir. Bu aşı biyolojik olarak güvenilen, iyi tolere edilebilen, yan etki göstermeyen ve çevreye herhangi bir kirlilik oluşturmayan özelliktedir.
2.23. Sarcoptes scabiei
Sarcoptes scabiei Paramiyosinini (PAR) kodlayan gen bölgesi klonlanmış ve PAR-DNA aşısının farelerde karışık bir Th1/Th2 tepkisini indüklediği görülmüştür 63.
2.24. Hypoderma lineatum
Hypodermin C (HC) geni ökaryotik ekspresyon vektörü pVAX1'e klonlanmış, rekombinant plazmid pVAX1-HC, farelerin embriyonik fibroblastlarına (MEF) transfekte edilmiştir. Sonuç olarak serum antikor seviyelerinin ve lenfosit proliferasyon seviyelerinin kontrol grubundakinden önemli ölçüde daha yüksek olduğunu tespit edilmiştir 64.