Virüslere karşı hücresel immün yanıtta en etkili hücreler CD8+ T hücreleridir. Bu hücreler yalnızca tüm çekirdekli hücrelerde yerleşim gösteren major histocompatibility complex- I (MHC-I)in sunduğu antijenleri tanıma özelliğine sahiptir, dolayısıyla virüsle enfekte olan ve bunları sunabilen tüm hücreler sitotoksik T lenfositlerin hedefi olabilirler. Sitotoksik T lenfositleri, antijen-spesifik T hücre reseptörü (TCR) ile enfekte hücrelere bağlanır ve sitotoksik maddelerini hücre membranına boşaltırlar. Bu maddeler, enfekte hücrelerin apoptozisini harekete geçirerek ölümüne neden olurlar. Apoptozis sırasında aktive olan nükleazlar, hücreyi enfekte eden viral ajanların nükleik asitlerini parçalar. Bunların yanı sıra, uyarılan sitotoksik T hücreleri, salgıladıkları IFN-γ ile makrofajların virüsleri fagosite etme gücünü de arttırırlar. CD8+ sitotoksik T hücreleri bir kez etkinleştikten sonra virüslerin çoğaldıkları hücreleri lize eder ve tüm vücutta enfekte hücreleri tanıma, bağlama ve öldürmeyi sürdürürler
1, 2. Enfeksiyonun kontrolünde CD4+ T hücrelerinin rolleri de geniştir. CD4+ T hücre fonksiyonu genel olarak; CD8+ T hücre yanıtının geliştirilmesi, CD8+ T hücre belleğinin geliştirilmesi, miyeloid hücrelerin fagositik veya oksidatif patlama aktivitelerinin arttırılması ve B hücre-aracılı yanıta yardımcı olma şeklinde ifade edilebilir. Bu fonksiyonlar, T helper tip 1 (Th1) hücreleri, T helper tip 2 (Th2) hücreleri, T helper tip 17 (Th17) hücreleri, regülatör T (Treg) hücreleri, T foliküler helper (Tfh) hücreleri ve sitotoksik CD4+ T hücreleri gibi alt sınıflara geniş bir şekilde gruplandırılabilen CD4+ T hücreleri tarafından sağlanır
3. Akut viral enfeksiyon sonrası virüse karşı gelişen spesifik T hücre yanıtında bu hücreler tarafından salgılanan sitokin profillerinde enfeksiyon süresi boyunca önemli değişiklikler meydana gelir
4. Bu profil değişikliğinin hücre düzeyinde ölçülmesi, sitokin üreten hücrelerin fenotiplendirilmesine önemli katkı sağlayabilmektedir. Ayrıca viral vektörler ve DNA aşıları gibi T hücre yanıtını indükleyen aşılarda immünojenite, çoğu zaman sitokin bazlı yaklaşımlarla değerlendirilmektedir
5, 6.
İmmün yanıtın niteliksel ve niceliksel durumu hakkında veri elde edilmesinde çeşitli metotlar geliştirilmiştir. Bu metotlar, immünitenin altında yatan temel mekanizmaları ve klinik teşhislerin tasarımı ile uygulanacak tedavinin geliştirilmesine yardımcı olmaktadır. Standart metotlar heterojen hücre popülasyonlardaki ortalama cevabı ölçmektedir. Hücre proliferasyonu, sitolitik aktivite ve sitokin ekspresyonunu saptayan yaygın deneyler; virüsler, tümör hücreleri ve çeşitli mikroorganizmalara karşı hastalık patogenezi ve bağışıklığı hakkında önemli bilgiler vermektedir 7. T hücre belleğinin devamlılığı viral enfeksiyonlarda önem arz etmektedir. Bu amaçla, vaccinia virüs (VV), measles virüs (MV) ve yellow fever virüs (YFV) dahil olmak üzere çeşitli akut viral enfeksiyonlarda T hücre belleği araştırılmıştır 4.
Akım (Flow) Sitometri / Hücre Fenotiplemesine Dayalı Testler
Sitometri, hücrelerin veya biyolojik partiküllerin fiziksel yada kimyasal özelliklerinin ölçülmesidir. Flow sitometri ise, akan bir sıvının içerisindeki hücrelerin özelliklerinin incelenmesidir. Flow sitometrinin temel prensibi; hücrelerin boyut, şekil, DNA ve RNA içeriği, sitoplazmik granüleritesi açısından değerlendirilmesidir. Flow sitometrinin çalışma prensipleri 1870li yıllara kadar gitse de 1969 yıllında argon lazerinin kullanılmaya başlanması ve 1980li yıllarda ayırma işleminin bulunması ile önemli bir ivme kazanmış ve daha sonra sürekli olarak meydana gelen gelişmelerle günümüze kadar gelmiştir 8.
Flow sitometri ışık mikroskobuna göre çok daha fazla hücreyi daha kısa bir süre içerisinde inceleme imkanı sağlar. Bu teknik ile 1 saniyede 500 hücre sayılır ve ortalama 10000 hücre 20 saniyede analiz edilebilir 9. Floresansla aktive edilen flow sitometri, immünolojide rutin olarak kullanılan en güçlü teknolojilerden biridir. Tek hücre bazında, hücrelerin hem hızlı ve çok parametreli analizi için hem de yüksek oranda saflaştırılmış hücre popülasyonlarının ayrımında olanak sağlar. Bu hücre tipleri arasında ayrım yapma yeteneği, hücresel bağışıklık ve hastalık patogenezini anlamamız açısından çok önemlidir 10.
Tüm hücrelerin yüzeyinde veya hücre içerisinde hücreye spesifik antijenler mevcuttur. Flow sitometride hücrenin büyüklüğü, hücrenin iç yapısı (granüleritesi), ve hücrede incelenmek istenilen antijene ait monoklonal antikorun floresansı ölçülmektedir. Hücreler öncelikle monoklonal antikorlarla inkübe edilerek antijenlere bağlanmaları sağlanır. Her spesifik antikor FITC (Fluorescein isothiocyanate), PE (Phycoerythrin), PerCP (Peridinin chlorophyll protein complex) gibi floresan boyalarla işaretlendiği için belirli antijene sahip hücrelerin lazer ışını ile karşılaştığında verdiği floresan sinyalleri değerlendirerek o hücrenin hangi spesifik antijeni taşıdığı belirlenebilmektedir 11. Flow sitometri analizleri için hücrelerin sıvı içinde süspansiyon halinde bulunması gerekir. Bu amaçla kan hücreleri flow sitometride en çok incelenen hücreler olmuşlardır. Solid dokular için ise hücreler ayrıştırılıp hücre süspansiyonu haline getirilerek analizde kullanılmaktadır. Flow sitometri tekniği ile daha çok rutin laboratuvarlarda lökosit süspansiyonlarında analizler yapılmaktadır. Lökositlerin ayrılması ise hücre büyüklüğü ve granül yapısına göre yapılmaktadır 9, 11.
Aşağıda flow sitometri yöntemleri kullanılarak CD4+ ve CD8+ T hücre analizlerine yönelik yapılan bazı tekniklerden bahsedilmiştir.
1. Sitokin Akım Sitometrisi (Cytokine Flow Cytometry-CFC)/ İntrasellüler Sitokin Boyama (Intracellular Cytokine Staining-ICS)/ Yöntemi
Kan veya periferal kan mononükleer hücrelerin (Peripheral blood mononuclear cells-PBMC) antijen spesifik stimülasyonunun ardından protein salgılanmasının inhibisyonu ve birikmiş hücre içi sitokinlerin çok renkli akım sitometrisi ile ölçülmesi, sitokin flow sitometrisi (CFC) veya intrasellüler sitokin boyama (ICS) olarak adlandırılır. Uygulanan stimülasyona bağlı olarak, CD4+ veya CD8+ T hücre cevaplarını tespit etmek için kullanılabilen ve iyi çalışan yöntemlerden birisidir. ICS tekniği ile çoklu sitokinler (veya kemokinler) ölçülebilir. IFN-γ, IL-2, IL-4, IL-17 ve TNF-α yaygın olarak ölçülen sitokinler arasındadır 12,13 (Şekil 1).
CFC gibi teknikler kullanılarak kronik viral enfeksiyonların (HIV, HCV ve CMV gibi) akut enfeksiyon sırasında CD4+ ve CD8+ T hücre yanıtlarını indüklediği açıkça görülmüştür. Fonksiyonel antijen-spesifik T hücrelerinin frekanslarının belirlenmesi, birçok hastalık modelinde araştırmacıların CD4+ ve CD8+ T hücre yanıtlarının gücü ile immün koruma arasındaki ilişkiyi değerlendirmesine olanak sağlamıştır. Örneğin, farelerin LCMV (lymphocytic choriomeningitis virus) enfeksiyonuna karşı güçlü immün yanıtı uzun süreli hafıza ile ilişkili olan güçlü CD4+ T hücre sitokin yanıtları ile ilişkilidir 15.
Günümüzde ICS tekniği aşılama denemeleri sırasında immünojenite ölçüsü olarak T hücre reaktivitesini ölçmede en sık kullanılan yöntemlerden biridir. ICSnin en büyük avantajı hücrelerin tekli olarak çeşitli özelliklerinin tespit edilebilmesidir. Yöntem hücre popülasyonlarının önceden zenginleştirilmesine gerek kalmaksızın tam kan veya PBMCler üzerinde gerçekleştirilir. Ayrıca yöntem hızlı ve az maliyetlidir. Kan alımından sonra yaklaşık 8 saat gibi kısa sürede sonuç verebilir. ICS, HIV aşı klinik çalışmalarında hem CD4+ hem de CD8+ T hücresi yanıtlarını izlemek için kullanılmıştır 16. Sirivichayakul ve ark. 17 Taylandda yaptıkları bir faz I çalışmasında anti-HIV aşısının değerlendirilmesinde ICS testinin HIV aşısı immünojenitesini araştırmak için sınırlı kaynaklara sahip ülkelerde güvenilir bir şekilde kullanılabileceğini göstermişlerdir.
2. Tetramer Boyama (Tetramer Staining)
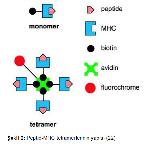
Antijen-spesifik T hücrelerinin kantitifikasyonu için kullanılan bir yöntem de tetramer boyamadır. MHC tetramer boyama olarak bilinen bu teknik, MHC-peptid komplekslerinin floresan oligomerleri kullanılarak flow sitometri ile antijen-spesifik T hücrelerinin analizine dayanmaktadır. İlk olarak 1996 yılında Altman ve ark. tarafından kullanılmıştır. Tetramerler T-hücre reseptörlerini güçlü bir avidite ile bağlayarak, yapısına konjuge edilmiş floresan molekülleri aracılığıyla etiketli hücrelerin tespit edilmesini sağlar 18, 19.
2.1. MHC Sınıf I Tetramerleri
MHC moleküllerinin tetramerik kompleksleri, özellikle viral enfeksiyonlarda ve aşılama sonrası in vitro olarak antijene spesifik T hücrelerinin belirlenmesinde önemli bir araç olarak ortaya çıkmıştır. T hücre fenotiplemesi, önceden toplam CD8 + T hücre havuzuna göre gerçekleştirilebilmiş bir metot iken daha sonraları MHC sınıf I tetramerlerinin geliştirilmesiyle birlikte rutin olarak antijen-spesifik T hücrelerin durumunu incelemek için kullanılmıştır. Bu tekniğin dayandığı temel prensip, antijen-spesifik T hücrelerin, MHC-peptid kompleksi içeren tetramerik molekül ile direkt olarak boyanmasıdır 20, 21.
Sınıf I moleküllerinin ağır ve hafif zincirlerini oluşturan proteinler, peptid-MHC kompleksi oluşturmak üzere epitop peptitlerle kaynaştırılır, ardından oluşan kompleks saflaştırılarak bir enzim ile biyotinleme yapılır. Biyotin ile işaretlenen peptid-MHC kompleksi 4:1 oranında avidin ile karıştırılarak tetramerik yapı elde edilir. Avidin molekülü bir florokrom ile konjuge edilir, böylece tetramerler ile etiketlenmiş spesifik T hücreleri flow sitometri ile kolayca tespit edilebilir 22 (Şekil 2).
2.2. MHC Sınıf II Tetramerleri
Antijen-spesifik CD4 hücrelerini tanımlamak için MHC-II tetramerlerinin sentezi ve kullanımı ile ilgili ilk rapor 1999'da Novak ve ark. 4 tarafından verilmiştir. Sınıf II tetramerlerin geliştirilmesi, çözünür sınıf II-peptid komplekslerinin hazırlanmasındaki zorluklar, antijen-spesifik CD4+ T hücrelerinin düşük frekansta olması ve MHC-peptid kompleks molekülleri arasındaki düşük afiniteler nedeniyle sınıf I tetramerlerden daha zor olmuştur, bu nedenle problemlerin üstesinden gelmek için farklı stratejiler kullanılmıştır. Birçok MHC sınıf II multimeri, insekt hücrelerinde üretilen rekombinant proteinler kullanılarak yapılmıştır. Bazı araştırmacılar biotin-avidin bağlanmasına dayanan tetramerlere ek olarak, dimerler oluşturmak için sınıf II moleküllerini immünoglobulin ağır zincirine veya Fc kısmına bağlamışlardır. Bazı araştırmacılar ise peptid-MHC kompleksi oluşturmak için α ve β zincirlerinin kombinasyonunda lösin fermuarı kullanmışlardır. Bu stratejiler, antijene spesifik CD4+ T hücrelerini tespit etmek için kullanılan sınıf II tetramerlerinin başarılı bir şekilde üretilmesine yol açmıştır 4, 22.
İnsan tetramerleri, çeşitli hastalık modellerindede hem CD8+ hem de CD4+ antijene spesifik T hücrelerini tanımlamak için başarıyla kullanılmıştır. İnfluenza aşısı ile ilgili yapılan bir çalışmada aşılama öncesi ve sonrasında spesifik CD8+ T hücreleri ölçmek için M1 peptidi ile HLA-A2 tetrameri kullanılmıştır. Yine kronik olarak Hepatit C virüsü (HCV) ile enfekte olmuş ve iyileşmiş hasta bireylerde HCV'ye özgü CD8+ T hücrelerinin tek hücre seviyesindeki efektör fonksiyonu ve fenotipini araştırmak için HCV NS3 epitopuna özgü HLA-A2 tetrameri kullanılmıştır 18, 23.
Antijen-spesifik CD8+ T hücrelerinin tetramer boyaması, ICSye kıyasla hassasiyet açısından daha fazla avantaj sağlamıştır. Tetramer kullanımının dezavantajı, sadece spesifik bir MHC-peptid çiftini tanıyan T hücrelerinin, tek bir tetramer tarafından tespit edilebilmesi ve dolayısıyla antijen epitopa spesifik olmasıdır 18.
3. Aktivasyonla İndüklenmiş Markır Testi (Activation-İnduced Marker Assay-AIM)
Sınıf II multimerlerinin sentezi ve kullanımı ile ilgili zorluklara ve dolayısıyla epitopa özel CD4+ T hücrelerini tanımlama ve izole etme zorluğuna bağlı olarak, CD4+ T hücre fonksiyonunun moleküler temelinin anlaşılması CD8+ T hücrelerinin gerisinde kalmıştır. Dolayısıyla antijene spesifik T hücrelerinin canlı izolasyonuna izin veren bu yöntem gerekli görülmüştür 7.
Bu teknik, ICS'ye benzer bir şekilde uygulanabilir fakat, hücre içi sitokinleri boyamadan ziyade, PDL1, CD25 ve OX40 dahil olmak üzere T hücre reseptörüyle indüklenen hücre yüzeyi markırları için boyama yapılır. Bu markırların farklı kombinasyonları AIM+ T hücre popülasyonlarını tanımlamada kullanılmıştır. Bu yöntemin avantajı, tüm Th1, Th2, Th17, Tfh ve Treg gibi belirli bir sitokin veya efektör molekülleri saptaması ve daha geniş antijen-spesifik hücre popülasyonunu tespit edebilmesidir. Deney başlangıçta ICS ile saptanması zor olan T-foliküler helper hücrelerini saptamak için geliştirilmiştir, daha sonra ise aşılama ile veya enfeksiyonla antijene maruz bırakıldıktan sonra CD4+ T hücre değerlendirmesi için de kullanılmıştır. Yöntem ICSden daha yüksek antijen-spesifik T hücre seviyelerini göstermiştir 7, 24, 25. Yapılan bir çalışmada 6, AIM analizlerinin hem CD4+ hem de CD8+ T hücrelerini tespit etmek için kullanılabileceği gösterilmiştir. Çalışmada CD8+ AIM yanıtları ICSye benzer sonuç verirken, CD4+ AIM yanıtları ise saptanmamıştır. Bu durumun nedeni, ICS ile karşılaştırıldığında AIM deneylerinin daha fazla CD4+ alt popülasyonu saptaması olarak düşünülmüştür. Yapılan bu çalışma AIM deneylerinin, tek başına ICS ile tespit edilmesi zor olan yeni bellek T hücre yanıtlarını saptamak için aşı çalışmalarında da kullanılabileceğini göstermiştir 24. Zaunders ve ark. 26 tarafından geliştirilen başka bir flow sitometri çalışmasında ise antijen-spesifik CD4+ T hücrelerini analiz etmek için CD25 (IL-2Ra) ve CD134/OX40 (bir TNF reseptörü aile üyesi) reseptörlerinin ortak ekspresyonu uygulanmıştır. COVID-19 enfeksiyonu geçirmiş hastalarda SARS-CoV-2'ye spesifik CD8+ T hücrelerini ölçmek için AIM ve ICS metodolojileri kullanılmıştır. CD8+ T hücre yanıtları AIM tarafından vakaların %70'inde saptanmıştır 27.
4. Boncuk Temelli Akım Sitometri Yöntemi (Bead-Based Flow Cytometric Assay-Luminex ve LegendPlexTM )
Yöntem yüksek doğruluk oranı, sensitivite, tekrarlanabilirlik, yüksek verim ve az miktarda numune (25-50μL gibi) kullanarak birden fazla analiti ölçme yeteneği nedeniyle sitokin testlerinde en çok kullanılan analiz yöntemlerinden biri olmuştur. Bu tür çalışmalar, mikrobeadlar üzerinde hareketsiz hale getirilen yakalama antikorlarını kullandığından sandviç ELISA prensibi üzerine inşa edilmiştir 28.
Luminex deneyleri, farklı floresan (kırmızı ve kızılötesi) boyalarla boyanmış mikrometre ölçekli boncuklar (mikrosfer) kullanılarak çoklu sitokin analizlerinin yapılmasına yöneliktir. Boncuklar polistiren veya manyetik yapıda olabilir. Flow sitometride bu mikrosferlerin her birinin bir lazerle uyarılması sonucu farklı dalga boylarında ışık yayılmaktadır. Öncelikle her bir boncuk, yüzeyi bir yakalama antikoru (sitokin, kemokin veya bir enfeksiyon biyo-markırına spesifik) ile konjuge edilir. Daha sonra ilgilenilen biyolojik numune (serum veya hücre süpernatantı) her biri farklı bir sitokin için spesifik olan mikrosfer karışımı ile birleştirilir ve 96 kuyucuklu bir plaka içerisinde inkübe edilir. Biyolojik numune-mikrosfer karışımı daha sonra yıkanır ve istenen sitokinlere özgü bir tespit antikoru ilave edilir. Bu tespit antikorları ayrıca farklı floresan özellikteki bir raportör boya ile konjüge edilir. Bir kez daha yıkandıktan sonra mikrosfer-sitokin-raportör karışımı bir akış haznesinden geçirilerek tekli boncuklar bir süspansiyon halinde analiz edilir. Çeşitli mikrosfer setleri kullanarak 96 kuyucuklu bir plakanın bir kuyucuğunda aynı anda 100'e kadar analit ölçülebilmektedir 24, 28, 29.
Luminex, fizyolojik ve patolojik hastalık süreçlerinde sitokinlerin değerlendirilmesi ve analiz edilmesinde önemli bir araçtır 29. Alhetheel ve ark. 30 luminex yardımıyla MERS-CoV ile enfekte 49 hastada Th1/Th2 düzeylerini ortaya koymak için IFN-γ, IL-12, IL-2, IL-10, IL-13, IL-4 ve IL-5 plazma sitokin seviyelerini ölçmüştür. Hepatit B ile kronik olarak enfekte hastalarda serum HBV pregenomik RNAnın Th1 ve Th2 ile korelasyonunu araştıran bir çalışmada 31 sitokin analizlerinin yapılmasında, Rubbo ve ark. 32 tarafından yapılan bir çalışmada HIV-1 ve HSV (Herpes Simplex Virus) ile ko-enfekte bireyler ile HIV-1 ile enfekte olmayıp HSV ile enfekte bireyler arasındaki T hücre yanıtlarının karşılaştırılmasında, Ebola virüs enfeksiyonunun (EBOV) patofizyolojisini anlamak ve hastalık mekanizması hakkında önemli biyobelirteçleri (T hücre, sitokin vb.) ortaya koymak için yapılan başka bir çalışmada 33 luminex metodu kullanılmıştır.
Luminex teknolojisi, klinik öncesi ve klinik çalışmalarında aşılama ile indüklenen sitokin proteinlerinin araştırılmasında da kullanılmıştır. Groot ve ark. 34 VZV aşılama sonrası Th1, Th2, Th17, Treg ve sitotoksik T hücre yanıtları (IL-10, IL-12, IL-13, IL-17, TNFα, IP-10, Granzyme B) için kullanmıştır. H5N1 5, HIV-1 35, EBOV 36 gibi viral aşı çalışmalarında da kullanılmıştır.
BioLegend'in LegendPlexTM testi 37, iki temel antikor arasında bir analitin yakalandığı sandviç temelli immunoassay ile aynı temel prensipleri kullanan boncuk temelli bir immüno-assay yöntemidir.
LegendPlex testinin prensibi Luminexe benzerdir. Bir analit-spesifik antikora konjuge edilmiş farklı düzeylerde APC floresan içeren boncuk kullanılır. Aynı zamanda bir numunenin saptanması için biyotin yakalama antikoru ve strepdavidin-PE reaktifi kullanılır. İki farklı büyüklükte boncuk kullanılarak farklı analitler renk ve boyut bazında ayırt edilebilir. Luminex platformuna kıyasla daha az sayıda analit tespit edilebilmektedir 24 (Şekil 3).
Dengue virüs enfeksiyonu sırasında Toll-like receptor 2nin bir rol oynayıp oynamadığını araştıran bir çalışmada enflamatuar sitokin ekspresyonu LEGENDplex
TM ile analiz edilmiştir
38. Farklılaşmış epitel hücrelerinin Respiratory Syncytial Virus enfeksiyonuna karşı antiviral yanıtını değerlendiren bir çalışmada
39, enfeksiyondan sonraki 1, 2 ve 3. günlerde bazı sitokin seviyeleri LegendPlex antivirüs yanıt paneli kullanılarak ölçülmüştür. Başka bir çalışmada
40, Batı Nil Virüsü enfeksiyonunda kapsamlı bir antiviral sitokin panelini (özellikle T lenfosit yanıtı ile ilgili olanlar) oluşturmak için bu yöntem kullanılmıştır.