Antibiyotikler, Bacillaceae, Actinomycetales, Streptomyces vb. bazı mikroorganizmalar tarafından çok basamaklı biyosentetik yollar ile üretilen sekonder metabolitler olup mikroorganizmalar için bir savunma özelliği ve hayatta kalma mekanizması olarak nitelendirilmektedir
1. Bakteriyel hastalıklar 19. yüzyılın ortalarına kadar ciddi mortalite ve morbiditeye sahip iken antibiyotiklerin keşfi bu etkilerde önemli düşüşler sağlayarak modern tıbbın temelini oluşturmuştur
2.
Antibiyotikler geçmişten günümüze bakteriyel hastalıkların sağaltımında önemli bir yer tutmasına rağmen toplum tarafından bu ilaçlar önemsenmemiş ve bilinçsizce kullanılmıştır 3. Antibiyotiklerin başlıca insan hekimliği, veteriner hekimlik ve çevre gibi alanlarda fazla ve yanlış kullanımı, kalıntı sürelerinin takipsizliği ve çevresel bulaşma ciddi bir şekilde artan antimikrobiyal dirence ve buna bağlı olarak antibiyotiklere dirençli bakterilerin ortaya çıkmasına yol açmıştır 4-8. Bu durum her geçen gün etkili antibiyotik sayısının azalmasına ve dirençli patojen bakterilerin sayısında da artmaya sebep olmuştur 9, 10.
Antimikrobiyal direnç (AMR) dünya çapında insan ve hayvan sağlığını tehdit eden en önemli sorunlardan biri haline gelmiştir 11. Öyle ki ilaca dirençli patojenlerin sebep olduğu enfeksiyonlardan kaynaklı dünyada her yıl en az 700.000 kişinin öldüğü tahmin edilmekte ve antimikrobiyal direnç ele alınmadığı taktirde bu sayının 2050 yılına kadar 10 milyona çıkabileceği öngörülmektedir 12. Günümüzde antibiyotiğe dirençli patojenlerin neden olduğu ciddi enfeksiyonlar artık mevcut tedavilere yanıt vermemekle beraber kullanılan antibiyotiklere karşı direnç de geliştirebilmektedir 10. 2019 yılının sonlarında ortaya çıkan ve milyonlarca insanın ölümüne sebep olan COVİD-19 pandemisi birçok sorunu da beraberinde getirmiştir 13. Bu sorunlardan belki de en önemlisi, özellikle hastanede yatan ve bağışıklık sistemi zayıflamış hastalarda gözlenen, genellikle çoklu ilaca dirençli patojenlerle ilişkili yüksek sayıda ikincil enfeksiyonlardır 14. COVİD-19 tedavisinde antibiyotiklerin yoğun bir şekilde kullanılmasının 15, 16 var olan AMRin daha da yayılmasına neden olabileceği bildirilmiştir 17, 18. Antibiyotik direncinin büyümesi ve tedavi seçeneklerinin hızla tükeniyor olmasının yakın gelecekte büyük olasılıkla daha fazla olumsuz klinik, ekonomik ve toplumsal sonuçları olacaktır 19, 20. Bu duruma karşı Dünya Sağlık Örgütü (DSÖ) 2017 yılında yeni antibiyotik geliştirilmesi gereken antibiyotiğe dirençli patojenler listesi yayınlamış ve bu liste Tablo 1de sunulmuştur 21.
Artan bu klinik ihtiyaca rağmen, yanlış ekonomik modeller nedeniyle büyük ilaç şirketlerinin antibiyotik araştırmalarından çekilmesi, piyasaya yeni antibiyotik sınıflarının ulaşmaması ile sonuçlanmış, antibiyotik keşfi akademik ve küçük biyoteknoloji şirketleri tarafından araştırılmaya bırakılmıştır 22. Ancak yetersiz finansman kaynağı nedeniyle araştırmalar sonuçsuz kalmaktadır 23.
Tarihsel olarak, son 40 yılda üretilen antibakteriyellerin yaklaşık %60'ı doğal kaynaklardan türetilmiştir 24. Var olan antibiyotiklerden sentetik olarak üretilen yeni moleküller daha çok önümüzdeki birkaç yıl için etkinliğini korurken, mikrobiyal doğal ürünlerden keşfedilmeyi bekleyen yeni moleküllerin AMR sorununu azaltacağı öngörülmektedir 25.
Bu derlemede doğal kaynaklardan yeni antimikrobiyal maddelerin tespit edilmesi ve tanımlanmasında kullanılan yöntemler hakkında genel bilgi verilmiştir.
2. Antimikrobiyal Etken Madde Tarama Yöntemleri
2.1.Örneklerin Toplanması, Birincil Tarama ve İdentifikasyonu
Bitki, su, toprak ve hayvanlardan alınan örnekler su, sıcak su, damıtılmış su, metanol, %0.9 NaCl izotonik, aseton, kloroform gibi çeşitli çözeltilerde çözdürülür, karıştırılır, tortunun çökmesi beklenir ve süpernatant kısım birincil tarama için alınır 26-29.
Birincil tarama için daha önceden mikroorganizma ekilen farklı besi yerlerine (Nutrient Agar, LB Broth Agar, Actinomycete Isolation Agar, Potato Dextrose Agar ve Sabouraud-2 % Glucose Agar gibi) numunenin (süpernatant) belirli bir miktarda ekimi yapılır ve her biri birbirinden farklı sıcaklıklarda (28 °C, 35 °C veya 50 °C) inkübasyona bırakılır 3. İnkübasyon bittikten sonra, çevresinde temiz alan oluşturan mikroorganizmalar seçilir 29, 30.
Belirlenen mikroorganizmaların izolasyon, tanı ve identifikasyonu ise temel mikrobiyolojik yöntemler kullanılarak yapılır 31.
2.2. İkincil Tarama
Birincil tarama sonucu seçilen mikroorganizmaların antimikrobiyal aktiviteleri test mikroorganizmaları kullanılarak çoğunlukla çapraz çizgi metodu ile belirlenir 29. Antimikrobiyal aktivite tayini için Bacillus subtilis, Bacillus licheniformis, Staphylococcus aureus, Salmonella enteritidis, Escherichia coli, Proteus vulgaris, Enterococcus faecalis, Agrobacterium tumefaciens ve Klebsiella pneumoniae gibi çeşitli test mikroorganizmaları kullanılır 30.
2.2.1. Çapraz-Çizgi Yöntemi(Cross-Streak)
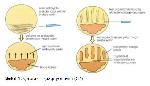
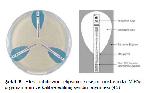
Çapraz-çizgi (cross-streak) metodu yeni mikrobiyal izolatlardan antibiyotik taramak amacıyla ilk defa Sir Alexander Fleming tarafından kullanılmıştır. Bu yönteme göre olası antibiyotik üreticisi olan organizma petri kabının yarısından az bir kısmını kaplayacak şekilde ekilir ve belirli bir sıcaklıkta inkübe edilir. Yeterli büyüme oluştuktan sonra sıvı besi yerinde geliştirilmiş olan test bakterileri olası antibiyotik üreticisi olan bakteri hücre kütlesine dikey olacak şekilde öze ile çizgi ekim yapılarak inkübasyona bırakılır. İnkübasyon sonunda ortaya çıkan inhibisyon zonları test bakterilerinin üreyemediğini ve bu da bakterinin etkili bir antibiyotik ürettiğini göstermektedir (Şekil 1) (32).
Bu yöntemle inhibisyon zonu oluşturan mikroorganizmalar antimikrobiyal aktivite tayini için seçilir 29.
2.3. Antimikrobiyal Aktivite Tayini
Antimikrobiyal aktivite tayini, inhibisyon zonu oluşturan mikroorganizmaların etkinliklerini belirlemek amacıyla kullanılır. Antimikrobiyal aktivite tayini için çeşitli in vitro yöntemler kullanılmaktadır. Bu yöntemlerin amacı maddenin antimikrobiyal etkisinin olup olmadığı, var ise minimal inhibisyon konsantrasyonu (MİK) ve mikroorganizma spektrumu belirlenir. Antimikrobiyal aktivite testleri içinde en uygun yöntemi seçmek önemlidir. Yöntemin seçiminde; maddelerin miktarı, sayısı, çözünürlüğü ayrıca kullanılacak mikroorganizmanın yoğunluğu, özelliği ve cinsi rol oynar ve en önemlisi sonuçların tekrarlanabilir ve güvenilir olması gereklidir 33. Antimikrobiyal aktivite testlerinin değerlendirilmesinde yaygın şekilde Klinik ve Laboratuvar Standartları Enstitüsü (Clinical and Laboratory Standards Institute, CLSI) standartları kullanılmaktadır 34. Antimikrobiyal aktivite testleri bu standarda göre bir antimikrobiyal ajanın belli bir bakteri türüne karşı in vitro etkinliğini tespit etmek amacıyla uygulanan testlerdir. Bu testler içerisinde en çok difüzyon, dilüsyon ve epsilometre testi (Etest) olmak üzere üç yöntemden yararlanılmaktadır 34.
2.3.1. Difüzyon Yöntemleri
2.3.1.1. Disk Difüzyon Testi
Disk difüzyon testi laboratuvarlarda antibiyotik duyarlılığının tespitinde en çok kullanılan yöntemdir. Bu yöntemin en önemli avantajı uygulaması kolay ve ucuz olmasıdır. Kirby-Bauer tarafından geliştirilmiş olduğundan bu isimlerle de anılmaktadır 35. Test, kağıt olan disklere emdirilen antibiyotiğin, daha önceden duyarlılığı araştırılan organizmanın inoküle edildiği besi yerine difüze olması temeline dayanmaktadır. Bu amaçla; miktarları belirli antibiyotik emdirilmiş kağıt diskler, test için kullanılacak olan mikroorganizmanın inoküle edildiği katı besi yerlerine yerleştirilirler. Bir süre sonra diskler çözünüp besi yerine doğru difüze olurken, inoküle edilen mikroorganizma da çoğalmaya başlar. İnkübasyondan sonra diskin çevresinde mikroorganizma üremesi görülmez. Diske emdirilen madde mikroorganizmaya ne kadar duyarlı ise etrafında oluşan inhibisyon zonu o kadar geniş olacaktır. İnhibisyon zonu ölçülerek (çapı mm şeklinde ölçülerek), standart zon tablolarına göre karşılaştırmalar yapılır ve test mikroorganizmasına karşı hali hazırda kullanılan antibiyotiklere karşı etkinlik durumu belirlenir (Şekil 2) 36.

Büyütmek İçin Tıklayın |
Şekil 2: %50 lik ethanol ekstratalarının disk difüzyon yöntemi kullanılarak belirlenen inhibisyon alanları (mm). 1; Staphylococcus aureus , 2; Escherichia coli , 3; Bacillus subtilis (36) |
Bakteriyostatik ve bakterisidal etkiler bu yöntemle ayırt edilemez. Besi yeri olarak genellikle Mueller Hinton, Nutrient agar, Tryptone Soya agar vb. kullanılır. Disk difüzyon testi bize kalitatif sonuçlar sağlar ve MİK hesaplaması mümkün değildir 33. Duyarlılık kategorileri şeklinde sonuçlar verir ve organizmalar, test edilen antimikrobiyal bileşiğe duyarlı, orta veya dirençli olarak kategorize edilir 37.
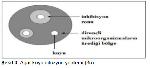
2.3.1.2. Agar Kuyu Difüzyon Testi
Şekil 3de gösterildiği gibi agar kuyu difüzyon yönteminde test mikroorganizmalarının bulunduğu agar plakları yüzeyine steril kuyucuklar açılır. Antibiyotik numuneleri kuyucuklara belirli miktarda etrafa taşmayacak şekilde doldurulur. Daha sonra kuyulardaki antibiyotik agar içerisine yayılır ve test mikroorganizmasına etkili olduğu düzeylerde üremeyi durdurur. Böylece, Şekil 3de görüldüğü gibi kuyucukların çevresinde test mikroorganizmalarının üremediği dairesel bir inhibisyon zonu oluşur 38.
2.3.2. Dilüsyon Yöntemleri
Dilüsyon yöntemleri numunenin suda homojen bir şekilde dağılmasını gerektiren tekniklerdir. Esas olarak bir ekstraktın uçucu yağın veya saf maddenin MİK değerlerini belirlemek için kullanılır 33. Antimikrobiyal aktivitenin ön taramasında kullanılabilirler. Dilüsyon yönteminde bulanıklık, bakteri yoğunluğunun bir göstergesi olarak alınır. Büyüme olmadığında ise ortam berrak kalır 39.
Dilüsyon yöntemleri difüzyon tekniklerine göre daha küçük ekstrakt hacimleri için geliştirilmiş hassasiyet, kantitatif analiz ve test numunesinin bakteriyostatik ve bakterisidal etkilerini ayırt etme yeteneği gibi bazı avantajlar sunar. Bir dizi mikroorganizma için kullanılabilen ekonomik bir testtir ve oldukça tekrarlanabilir sonuçlar verir. Tüp dilüsyon ve agar dilüsyon yöntemi olmak üzere iki farklı dilüsyon testi vardır 37.
2.3.2.1. Tüp Dilüsyon Yöntemi
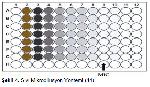
Antibiyotik duyarlılık testlerinin gerçekleştirilmesine yönelik geliştirilen tüp dilüsyon yöntemi, patojenik organizmalarla ilgili olarak minimum inhibitör konsantrasyonunu tanımlamak için yaygın olarak kullanılan bir yöntemdir. Ayrıca, agar difüzyon testindeki inhibisyon bölgesinin boyutu ile minimal inhibitör konsantrasyonlarını karşılaştırmak için bir referans olarak kullanılır 40. Ayrıca bu yöntem, bir antibiyotiğe direnç seviyelerini belirlemek için de kullanılır. Antibiyotiğin seri dilüsyonları, standart sayıda organizma ile aşılanmış ve öngörülen bir süre boyunca inkübe edilmiş sıvı bir ortamda yapılır. Bulanıklık görünümünü önleyen en düşük antibiyotik konsantrasyonu (en yüksek seyreltme), MİK olarak kabul edilir 41. Bu yöntemde çoğunlukla katyon (kalsiyum ve magnezyum) eklenmiş Mueller-Hinton buyyon besi yeri kullanılır 33. Test edilecek antimikrobiyal ajanlar özel çözücüler içinde hazırlanır ve ardından sıvı besi yerlerinde iki kat azalan sulandırılmalar yapılır. Daha sonra test mikroorganizması standart bir miktarda hazırlanıp, antimikrobiyal ajanların bulunduğu besi yerlerine eşit miktarlarda eklenir. Ayrıca sadece besi yeri konmuş bir tüp, besi yeri kontrolü olarak ve antimikrobiyal ajan katılmayan ancak test mikroorganizması eklenmiş bir besi yeri de kontrol amaçlı olarak hazırlanır 42. Besi yerleri bir gece 35°C'de inkübasyona bırakıldıktan sonra test mikroorganizması üremesini gösteren bulanıklık yönünden incelenir. Test mikroorganizmasının üremesini önleyen ve gözle görünür bir bulanıklığın olmadığı en düşük ilaç konsantrasyonu, MİK olarak değerlendirilir (Şekil 4) 43, 44.
2.3.2.2. Agar Dilüsyon Yöntemi
Agar dilüsyon, ekstraktların antimikrobiyal potansiyelini araştırmak için iyi bilinen bir yöntemdir. Yaygın olarak yeni antimikrobiyal ajanların ve duyarlılık testi protokollerinin değerlendirilmesi için bir referans yöntem olarak kullanılır 45. Bu yöntemin prensipleri tüp dilüsyon yöntemiyle aynıdır. Aralarındaki tek fark antibiyotik sulandırımlarının agar ile karıştırılarak petri plaklarına dökülmesidir. Böylece her plakta antibiyotiğin farklı konsantrasyonları bulunur. Bu yöntem için de tüp dilüsyonda olduğu gibi önerilen besi yeri Mueller-Hinton agardır 46. Agar dilüsyon yönteminde antimikrobiyal ajan, filtre ile sterilize edildikten sonra erimiş agar ortamına dahil edilir ve her plaka farklı bir konsantrasyonu içerir. Muller-Hinton agar, test için kullanılan besi yerinin organizmalara ve bazı durumlarda test edilecek antibiyotiğe göre belirlenmesine rağmen yaygın olarak kullanılmaktadır 33. MİK, organizmanın büyümesini tamamen inhibe eden en düşük antibiyotik konsantrasyonu olarak okunur. Aşı veya tek bir koloninin neden olduğu hafif bir bulanıklık, büyüme olarak okunmamalıdır. Agar dilüsyon plakalarını hazırlamak için gereken işçilik ve nispeten kısa raf ömürleri bu yöntemin dezavantajlarıdır. Ek olarak, duyarlılık sonuçlarının manuel olarak değerlendirilmesi ve yorumlanması zaman alıcı olabilir (Şekil 5) 45.
2.3.3. Epsilometre Testi (Etest)
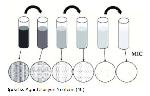
İsveç'te geliştirilmiş, hem disk difüzyon hem de agar dilüsyon yöntemlerinin prensiplerini birleştiren bir gradyan tekniği olan yenilikçi bir ticari antimikrobiyal duyarlılık testidir 46. İlk olarak, 1988'de Antimikrobiyal Ajanlar ve Kemoterapi (ICAAC) toplantısında sunulmuştur. Etest plastik şeritler, kuru formda antimikrobiyal konsantrasyon gradyanı ile emdirilir. Etest şeridinin üst yüzeyinin bir ölçeği vardır; karşılık gelen bir MİK aralığında kalibre edilir. Test organizması ile aşılanmış agar plakasının yüzeyine yerleştirildiğinde, test şeridi üzerindeki antimikrobiyal, sürekli gradyan tarzında derhal plakaya aktarılır. Optimum inkübasyon süresinden sonra, antimikrobiyal aktivite, şerit etrafında inhibe edilmiş büyümenin bir elipsi olarak görülür. MİK değeri, elipsin ölçekle kesiştiği noktadan elde edilir. Çoğu laboratuvar ortamında yüksek oranda tekrarlanabilir sonuçlar verir (Şekil 6) 45.
Büyütmek İçin Tıklayın |
Şekil 6: Etest inhibisyon elipsinin kesişim noktasında MİK'yi organizmanın ve kalibre edilmiş şeridin büyümesi 45 |
2.4. Antimikrobiyal Etken Maddenin Tanımlanması ve Tespiti
Elde edilen antimikrobiyal etken maddenin tanımlanması, kimliğinin, kimyasal ve moleküler yapısının belirlenmesi işlemleri ile ilgili birkaç yöntemden aşağıda kısaca bahsedilmiştir.
2.4.1. İnce Tabaka Kromatografisi (TLC) Yöntemi
"Thin layer chromatography" yani ince tabaka kromatografisi (TLC) olarak bilinen yöntem çok kolay, hızlı ve maliyetinin az olması nedeniyle; maddelerin kalitatif analizleri, ayrılması ve bilinmeyen karışımların kaç bileşenden oluştuğunu tespit etmek için sıkça kullanılan bir yöntemdir 47.
Bu yöntemde madde önce katı bir yüzeye (alüminyum veya slika) ekilir ve uygun bir çözücü içine batırılır böylece çözücünün katı yüzey üzerinde ilerlemesi sağlanır. Çözücünün yüzey üzerinde ilerlemesiyle birlikte madde de ilerleyecektir 47. Bu basit yöntemle metabolitler kültürden kesilen küçük miselyum tıpasına bir damla çözücü damlatılarak ekstrakte edilir. Ardından tıpa ıslatılmış tarafı aşağı gelecek şekilde bir TLC plakasına birkaç saniye süreyle yerleştirilir ve daha sonra tıpa çıkarılır. Plaka yıkanır ve floresanla veya seçici püskürtmeden sonra ultraviole (UV) ışığı altında görselleştirilir. Yöntem ilkel görünse de ilkel koşullar altında bile sınıflandırma, tanımlama ve metabolit tespiti için etkili olduğu kanıtlanmıştır 48.
2.4.2. Nükleer Manyetik Rezonans (NMR) Yöntemi
Nükleer manyetik rezonans spektroskopisi (NMR) atom çekirdeğinin belirli manyetik özelliklerini kullanan bir araştırma tekniğidir 49. Nükleer manyetik rezonans olgusuna dayanan NMR spektroskopisi, içerisindeki atomun yapısı, reaksiyon durumu, dinamiği ve molekülün kimyasal yapısı hakkında ayrıntılı bilgi verir. Bu nedenle organik kimyada bilinmeyen maddelerin kimliğini doğrulamak için kullanılır 50. Doğal ürün ekstraktlarından bilinen veya istenmeyen bileşiklerin hızlı bir şekilde tanımlanması için kullanılır. Son birkaç yılda teknolojideki gelişmeler, sıvı kromatografi kütle spektrometrisi (LC-MS), LC-MS-MS, sıvı kromatografi nükleer manyetik rezonans (LC-NMR) gibi tandem analitik tekniklerin geliştirilmesine olanak sağlamıştır. LC-NMR, HPLC ayırma gücünü NMR üstün yapısal bilgi içeriğiyle birleştirir. Bu iki teknik geleneksel olarak ilgilenilen moleküllerin yapılarını izole etmek ve belirlemek için doğal ürün kimyagerleri tarafından kullanılan birincil cihazlar olmuştur 51. LC-NMR, LC-MS ile karşılaştırıldığında daha düşük hassasiyetine rağmen bilinen bileşiklerin hızlı bir şekilde tanımlanması ve yeni bileşiklerin yapı sınıflarının tanımlanması için güçlü bir araç sağlar. LC-NMR, özellikle LC-MS'den gelen verilerin eksik olduğu veya bir numunenin aktif bileşeninin güvenilir bir şekilde tanımlanmasına izin vermediği durumlarda yararlıdır 50.
2.4.3. Kütle Spektrometresi Yöntemleri
Kütle spektrometrisi (MS), çok çeşitli kimyasal bileşiklerin tanımlanması için kullanılan güçlü bir karakterizasyon tekniğidir. En basit haliyle MS, bir numunedeki kimyasal türlerin moleküler ağırlığını belirlemek için yalnızca bir araçtır. Bununla birlikte, modern makinelerden elde edilebilen yüksek çözünürlük ile izomerleri, izotopları ve hatta nominal olarak aynı moleküler ağırlıklara sahip bileşikleri ayırt etmek mümkündür. Birçok iyonizasyon tekniği vardır. Bunlardan en önemlileri elektron iyonizasyonu (EI), elektrosprey iyonizasyonu (ESI) ve matriks ilişkili lazer desorpsiyon iyonizasyonu (MALDI)dur 52.
MS yöntemine doğal ürünlerin tanımlanmasında sıklıkla başvurulmaktadır. Bu yöntem ile bir karışımdaki metabolitlerin tespit edilmesinin yanı sıra metabolitin kimyasal yapısı hakkında da fazlaca bilgi alınmaktadır. MS yöntemi; sıvı kromatografi-kütle spektrometresi (Liquid chromatographymass spectrometry- LC-MS), nükleer manyetik rezonans (MS/NMR), gaz kromatografisi (Gas chromatography-GC/MS) gibi analitik yöntemler ile kombine kullanılarak doğal ürünlerin tespit edilmesini daha da kolaylaştırmaktadır 53.
2.4.4. Polymerase Chain Reaction (PCR -Polimeraz Zincir Reaksiyonu) ile Bakterilerin 16S rRNA Amplifikasyonu, Dizilimi ve Moleküler Tanımlanması
Bu yöntem ile elde edilen antimikrobiyal maddenin fenotipik identifikasyonu yapılır. Fenotipik identifikasyon yapılırken bakterilerdeki hedef genlere bakılır. Bu genlerde fonksiyonun evrim boyunca değişmemiş olması ve tüm bakteriler için korunmuş bir bölgeye sahip olması gibi bazı özellikler istenir. 16S rRNA geni ile tanımlama yapılmasının sebebi; bütün bakterilerde bu gen bulunur, fonksiyonel olarak korunmuştur, üzerinde iyi korunmuş ve heterojen bölgeler içerir. Ayrıca 16S rRNAnın yeterli veri tabanı bulunmaktadır. Bu yöntemde temel olarak çeşitli antimikrobiyal duyarlılık testleri sonucu elde edilen izolatlardan DNA örnekleri çoğaltılır ve 16S rRNA büyütülür. Amplifiye edilmiş 16S rRNA, PCRde saflaştırılmış ve dizinlenmiştir. Elde edilen diziler NCBI BLASTa (National Center for Biotechnology Information Basic Local Alignment Search Tool - Ulusal Biyoteknoloji Bilgi Merkezi Temel Yerel Hizalama Arama Aracı) tabi tutularak moleküler tanımlama yapılır 54.