Büyüyen bir tümörde yer alan yeni bir mikrovasküler ağ gelişiminde anjiogenezisin, hem lokal tümör büyümesinde hem de yayılmış tümörün son halinde major bir rol oynadığı gösterilmiştir
14. 2-3 mm
3 üzerindeki solid tümör büyümesi anjiogenezise bağlıdır ve VEGF hem endotelyal hücre büyümesinin hem de permeabilitesinin potent bir indükleyicisidir
15. VEGF önemli bir anjio-genetik faktör olarak davranır ve VEGFnin tümör neovaskülaritesinin promotoru olduğu gösterilmiştir
16,17. Daha önce yapılan çalışmalarda hemanjioblastomalarda, göğüs ve kolon karsinomalarında ve over kanserlerindeki stromal hücrelerde VEGFnin immünoreaktivitesi tespit edilmiştir
18,19. Ancak, insan prostat kanserinde VEGFnin varlığı ve regülasyonu hakkında çok az bilgi vardır
14. Son zamanlarda immünohistokimyasal metodların kullanıldığı bazı çalışmalarda PCa örneklerinde normal prostat ve BPH örneklerine oranla mikrovasküler dansite artışı tespit edilmiştir
4,20. Bunun aksine, Walsh ve arkadaşları ile Jones ve arkadaşları, serum VEGF seviyelerinin benign ile malign prostatik hastalığı birbirinden ayırt etmede kullanılamayacağını bildirmişlerdir
2. Ancak başka bir çalışmada, ortalama 20 veya 25 malign epitelyal hücrehücre içeren prostat tümörlerinde VEGF ekspresyonu gösterilmişken, BPH alanlarında VEGF ekspresyonu ya gösterilememiş ya da çok az oranda tespit edilmiştir
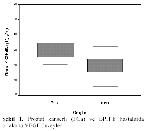
14. Bu çalışmada, BPHlı ve PCalı hastalarda plazma VEGF seviyelerin ölçülmüş ve PCalı grupta anlamlı derecede artmış plazma VEGF seviyeleri tespit edilmiştir. (p<0.05). İmmünohistokimyasal tekniklerin kullanıldığı çalışmaların çoğunda, BPH ve normal doku karşılaştırıldığında; PCa örneklerinde mikrovasküler dansitede artış olduğu, ayrıca vasküler dansitenin PCalı hastalarda patolojik evrenin bağımsız bir belirleyicisi olduğu gösterildiğinden, PCalı hastalarda artmış VEGF oranlarının olması şaşırtıcı olmaz
20,21.
Solid tümör gelişimi süresince, büyüyen lezyonlar besinleri ve uzaklaştırılan metabolik atıkları difüzyon yoluyla içeri almaya yetecek kadar küçükken, inisiyal hücreler avasküler bir ortamda klonal büyümeye uğrarlar. Ancak difüzyon lezyonun belirli bir boyutun üzerinde (~ = 2mm) büyümeye devam etmesini desteklemeye yeterli olmaz. Avasküler lezyonun progresyonu için neovaskülarite oluşturmak amacıyla anjiogenik aktiviteyi değiştirmek zorundadırlar 22. Bundan dolayı, VEGF ve hipoksi gibi bazı anjiogenik stimuluslar hastalığın progresi süresince destek vermek zorundadır 22. Daha önceden hipoksinin tümör agresivitesi veya metastazda bir rolü olduğu gösterilmiştir 23. Benzer şekilde hipoksi ve artmış VEGF ekspresyonu arasında pozitif bir korelasyon da bulunmuştur 24. Son zamanlarda, Cvetkovic ve arkadaşları insan PCasında anjiogenezis markırı VEGFnin artmış ekspresyonu ile artmış hipoksi derecesi arasında anlamlı bir ilişkiyi ortaya koymuşlardır 8. Bizim çalışmamızda da, PCalı hastalarda VEGF artışı ile birlikte lipid peroksidasyon ürünü olan MDAnın da anlamlı şekilde arttığı gösterildi. Jiang ve arkadaşları doğal olarak görülen polifenolik antioksidan silymarinin anjiogenik sitokin sekresyonunu inhibe etmedeki rolünü değerlendirmişlerdir ve silymarinin kanseri önleyici kimyasal etkiye ve kritik bir destek sağlayabilecek antianjiogenik bir potansiyele sahip olduğunu göstermişlerdir 22. Bu etkinin, kanser epitelyal hücrelerinden primer bir anjiogenik sitokin olan VEGFnin sekresyonunun direk inhibe edilmesi yolu ile olduğu öne sürülmüştür 22 Çalışmamızda, artmış plazma MDA seviyeleri ile gösterilen artmış oksidatif stres ve artmış plazma VEGF düzeyleri ile kanser arasındaki ilişki gösterilmiştir. Bu sonuç, kontrolsüz hücresel proliferasyonun bir sonucu olarak görülen kanser epitelyal hipoksisinin VEGF ekspresyonunun potent bir in vivo indükleyicisi olduğuna dair daha önceki gözlemleri desteklemektedir 25,26.
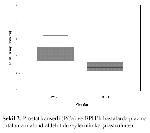
Nitrik oksit, kanserli olgularda kompleks bir role sahip bir moleküldür. NOnun DNAyı hasarlayarak hastalığın başlangıcı ile ilişkili olduğu ve ayrıca immün hücrelerin tümörisidal aktivitesi için NOnun gerekli olduğu gösterilmiştir 7,27. VEGFnin in vitro ve in vivo olarak endotelyal hücrelerden NO üretimini stimüle ettiği daha önceden gösterilmiştir 7. NO ise sonradan vasküler permeabilite ve anjiogenezisi arttırır 27. PCalı hastalarda BPHlı hastalara oranla artmış VEGF seviyeleri ile ilişkili olan anlamlı derecede yüksek seviyede plazma NO düzeyleri tespit ettik.
Yakın zamanda yapılan çalışmalar göstermiştir ki, NO en az iki mekanizma ile tümör gelişimi ile ilgili olabilir. Bunlardan ilki, anjiogenezisin stimülasyonu, diğeri ise DNA üzerinde serbest radikallerin direk aktivasyonu ile artmış mutagenezisidir. 28. Ek olarak, tümör hücrelerinden NO salınımı, NOin antiproliferatif etkisi aracılığı ile tümör indüklü immünsupresyonda rol almasından kaynaklanabilir 29. Sonuç olarak NO artışı, hem postat karsinomasının bir sonucu olabileceği gibi aynı zamanda prostat karsinomunun da nedeni olarak gösterilebilir.
Bizim sonuçlarımız BPHlı hastalara kıyasla PCalı hastalarda plazma VEGF seviyelerinin anlamlı derecede yüksek bulunduğunu ortaya koymuştur. Ayrıca anjiogenik stimulus, oksidatif stres ve NO ekspresyonu arasındaki sıkı ilişkinin, malign prostat hastalığının patogenezi ve hastalığın durumu hakkında etkili bazı faktörlerden olabileceği gösterilmiştir. Verilerimizin, insan prostat kanserinde anti-anjiogenezis ve antioksidan stratejiler ile ilgili tedavileri desteklediğine inanmaktayız.