Hayvan Materyali : Bu araştırmada, 190-250 g ağırlıklarında 30 adet, erkek, sağlıklı, Sprague-Dawley ırkı ratlar (Fırat Üniversitesi, Tıp Fakültesi, Deneysel Araştırma Merkezi, Elazığ) kullanıldı. Araştırmada deneysel uygulamalar laboratuvar hayvanlarının bakımı ve kullanımı şartlarına uygun olarak yürütüldü. Deneysel uygulamalar süresince ratlara standart ticari rat yemi ve musluk suyu
ad libitum sağlandı.
Deneysel İlaç Uygulamaları : Hayvanlar, bir grupta 6 rat olacak şekilde rastgele 5 gruba bölündü. Ratlara, böbrek hasarı yapıcı etkiye sebep olduğu iyi bilinen dozlarda; tek doz cisplatin (7 mg/kg) ve 6 gün süreyle gentamisin (100 mg/kg/gün) intraperitonel olarak enjekte edildi 6,7,9. Likopen ise mısır yağı içinde 4 mg/kg/gün dozunda mide gavajı şeklinde uygulandı. Çalışmada kullanılan likopenin dozu önceki çalışmalara dayanarak seçildi 8,17.
Deneysel uygulamalar aşağıdaki gibi yapıldı.
Grup 1 (Kontrol, n = 6): Ratlara, 10 gün 0.5 ml mısır yağı verilmesini takiben 6 gün süreyle günde 0.5 ml intraperitonel (i.p) yolla izotonik sodyum klorür;
Grup 2 (n = 6): Ratlara tek doz cisplatin;
Grup 3 (n = 6): Ratlara tek doz cisplatin uygulanmasını takiben 5 gün süreyle likopen;
Grup 4 (n = 6): Ratlara 6 gün süreyle gentamisin;
Grup 5 (n = 6): Ratlara gentamisin ile birlikte eş zamanlı olarak 6 gün süreyle likopen uygulamaları yapıldı.
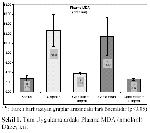
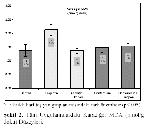
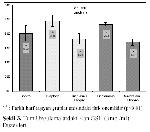
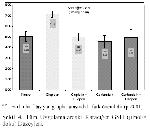
Örnek Alınması ve Biyokimyasal Analizler: Bütün gruplardaki hayvanlar, son uygulamadan 24 saat sonra sakrifiye edilerek, kan ve karaciğer dokusu örnekleri alındı. Kan örnekleri antikoagülan (%2 sodyum okzalat) içeren tüplere toplandı ve plazmalarını ayırmak için +4 ºCde 200 gde 5 dak santrifüje edildi. Plazma örnekleri ve karaciğer örnekleri biyokimyasal analizler yapılıncaya kadar -20 ºCde saklandı. Analizler öncesinde karaciğer dokuları tüm homojenatta 1:10 (a/h) bulunacak şekilde % 1.15 KCI içeren bir tampon ile Teflon-glass homojenizatörde homojenize edildi. Bu homojenatlar MDA ve GSH düzeylerini belirlemek için 18.000 gde, +4°Cde 15 dk. santrifüje edildi.
MDA düzeyleri tiyobarbitürik asit ile reaksiyonuna dayanan Ohkawa ve ark. 18nın modifiye yöntemine göre; GSH düzeyleri (nmol/g doku) Ellman 19ın bildirdiği spektrofotometrik yöntemlerle ölçüldü.
İlaç ve Kimyasal Maddeler: Gentamisin sülfat Eczacıbaşı (İstanbul, Turkey), Cisplatin (l0mg/l0ml, Code 1876A) Faulding Pharmaceuticals Pic (Warwickshire, UK), likopen (%10 FS DSM, Redivivo TM, Code 7803) Nutritional Products firmalarından, indirgenmiş glutatyon, glutatyon redüktaz, tiyobarbitürik asit, fosfotungustik asit, hidrojen peroksit, NADPH ve diğer kimyasallar Sigmadan (St Louis, MO, USA) ve Merck (Darmstadt, Germany)ten temin edildi.
İstatistiksel Analizler: Veriler ortalama değerler (X±SD) olarak verildi. Grup arasındaki karşılaştırmalar tek yönlü varyans analizini takiben Dunnet testiyle değerlendirildi. Sonuçların önem dereceleri p<0.01 ve p<0.05 olarak vurgulandı.