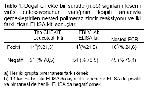Bu çalışmada, daha önceki yıllarda (1993-1994)
yapılan bir çalışmada
9 yüksek oranda (%7,1) BLV
prevalansı belirlenen doğal enfekte bir sürüde BLV
enfeksiyonunun varlığı nested-PCR ve iki farklı ticari
ELISA kitiyle araştırılmıştır. Ülkemizde BLV
enfeksiyonuna karşı, ithal hayvanlardan EBLV
seronegatiflik sertifikası istenmesi haricinde, ulusal bir
program mevcut değildi. Bu nedenle, 1993-1994 yılında
gerçekleştirilen test sonuçlarına göre seropozitif
hayvanlar kesime gönderilmemiş ve bu hayvanlar sürüde
tutulmuşlardır. Bu süre zarfında ise sürüde mevcut olan
ineklerin tohumlanması ve doğumları gerçekleştirilmiştir.
Ayrıca, sürüde horizantal bulaşmayı engelleyecek
herhangi bir tedbirin alınmadığı kaydedilmiştir. Bu
nedenle, yüksek insidansta bir BLV enfeksiyon varlığının
olacağı öngörüsü ile çalışma amacıyla bu sürü
seçilmiştir.
Mevcut çalışma sonunda 65 hayvanın iki farklı ELISA
ile araştırılması sonucu, birer örnek farklı olmakla birlikte,
14 (% 21,5) tanesinde BLV'a karşı antikor yanıtı tespit
edilmiştir. En az bir ELISA'da pozitif olan toplam 15
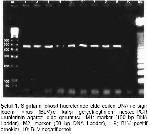
hayvanın hepsinde PCR ile BLV DNA'ları belirlenmiştir.
Ayrıca, PCR'da, her iki ELISA'da da seronegatif olan bir
sığırda BLV proviral DNA'sı tespit edilmiştir. Bu sonuçlar,
öncelikle testler arası duyarlılığı akla getirmektedir. Bu
nedenle, sonuç farklılığının PCR'da yalancı pozitiflikten
kaynaklanabilmesi ihtimali düşünülerek, özellikle
tartışmalı üç örnek (tek bir ELISA ile pozitif çıkan iki ve
ELISA negatif olup PCR pozitif olan bir örnek)
ekstraksiyon aşamasından başlayarak nested-PCR'da
yeniden çalışılmıştır ve aynı sonuçlar elde edilmiştir.
Daha önceki bazı çalışmalarda da BLV provirusun pozitif
olduğu ama serolojik olarak negatif olan sığırlar
bildirilmiştir2,5,11. Enfeksiyonun varlığına rağmen
seronegatiflik durumu genellikle enfeksiyonun ilk
safhalarıyla ilişkili olabilir. Ayrıca, immun sistemi
baskılayan sığırların mukozal hastalığı gibi enfeksiyonlar veya gebelik gibi fizyolojik faktörler de bu duruma neden
olabilmektedir12,13. Bunun yanısıra BLV'nin farklı
provirus varyantlarıyla enfekte olan hayvanlarda da
seronegatiflik bildirilmektedir11,14. Bu nedenle, bu
çalışmada da benzer durumlardan bir veya birkaçının
söz konusu olduğu düşünülebilir. Elde edilen sonuçlar bu
konuda devam eden tartışmalara katkı sağlamakla
birlikte, bu konuda ileride daha detaylı çalışmalara ihtiyaç
duyulmaktadır.
Son yıllarda ülkemizde, özellikle Ege ve Marmara
Bölgelerinde, sığır yetiştiriciliğinde bireysel hayvan
sağlığından ziyade sürü sağlığını gözeten yaklaşımların
yaygınlaştığını görmekteyiz. Bu nedenle de enfeksiyöz
hastalıklara verilen önemin arttığını ve birçok
enfeksiyona karşı sürülerin taranması ile ilgili taleplerin
geldiğini kaydetmekteyiz. Sürü taraması ile talepler,
genel olarak, sığırların mukozal hastalığı, sığırların
enfeksiyöz rinotrahitisi-enfeksiyöz balonopostitisi
(İBR/İPV) ve sığırların lökozuna karşı olmaktadır. Bu
bakımdan ülkemiz açısından mevcut çalışmanın verileri
ileriki yıllarda daha da önem arz edecektir.
Sonuç olarak, bu çalışmanın verilerine göre, BLV'e
karşı sürü bazında bir tarama programı uygulanması
durumunda, serolojik testler içinde en duyarlı olan ve
birçok avantajları bulunan ELISA'nın tek başına yetersiz
kalabileceği görülmüştür. Bu nedenle de, ELISA ile bir
tarama yapılması durumunda, özellikle prevalansı
yüksek çıkan sürülerde, bu sürülerin uzun süre klinik ile
hematolojik takibi ve ELISA'nın belirli bir süre sonra
tekrarı faydalı olacaktır. Ayrıca, bu çalışmada elde edilen
diğer bir önemli sonuç, enfekte bir sürüde eradikasyon
programı uygulanmadığı taktirde 10 yıl gibi bir sürede
enfeksiyonunun insidansının %7,1 oranından % 24,6 gibi
oldukça yüksek bir orana yükseldiği kaydedilmesidir. Bu
sonuçlar anneden yavruya plesanta yoluyla konjenital
olarak geçen ve rektal palpasyonla dahi saçılabildiği
gösterilen15 BLV gibi etkenlerle savaşımda sürü
takibinin önemini göstermektedir.