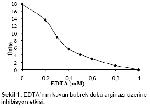
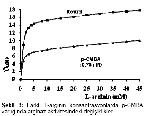
Koyun böbrek doku arginazı üzerine EDTA, p-CMBA, NEM’in etkisi araştırılmış, farklı konsantrasyonlarda inhibitörler enzim kaynağı ile reaksiyona sokularak inhibisyon etkisi incelenmiştir (Şekil
1,
4,
7). Bu şekilde 0,2 mM EDTA konsantrasyonunda enzimin %25 aktivite kaybettiği tespit edilmiş, konsantrasyon 1mM üstüne çıkıldığında ise aktivite kaybının %100 olduğu görülmüştür (Şekil
1). EDTA 0,35 mM kullanılarak farklı substrat yoğunluklarında enzim aktivitesi araştırılmış ve sonuçlar Lineweaver- Burk eğrisine dökülerek inhibisyon türü tespit edilmiştir (Şekil
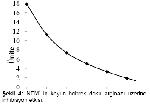
2,
3). Bu konsantrasyonda V
o-S grafiği kontrol grafiğine göre karşılaştırılmış ve inhibisyonun kompetetif tipte olduğu saptanmıştır. Burada enzimin Vmax değerlerinin değişmediği, Km değerlerinin değiştiği görülmüş, kontrolün Km değeri 1,6 mM iken EDTA varlığında Km değeri 3 mM olarak tespit edilmiştir.
Reczkowski ve ark.20, EDTA ve sitrat gibi şelatörlerin rat karaciğer arginazını inhibe ettiklerini bildirmişlerdir. Fakat enzim saflaştırıldıktan sonra Mn++ ile reaksiyona sokulması sonucu inhibitörlere maruz bırakıldığında enzimi fazla inhibe etmediklerini görmüşlerdir. Yapılan başka bir çalışmada, EDTA’nın fare karaciğer arginazına etki etmediği ortaya konmuştur25.
Genç koyunların yemlerine Ca+2- EDTA- Cu+2 kompleksi katılarak yapılan bir çalışmada, ilk 24 saatte arginaz aktivitesinin arttığı, daha sonra ise düştüğü ortaya konulmuştur26. Helicobacter pylori arginazının, 30 mM’lık L-arginin ve 0,25 mM’lık EDTA ile reaksiyona sokulmasıyla enzimin tamamen inhibe olduğu bildirilmiştir27.
Kuhn ve ark. (28), insan karaciğer arginazının farklı pH’larda EDTA ile reaksiyona sokulduğunda enzim aktivitesinde sürekli azalma olduğunu ortaya koymuşlardır.
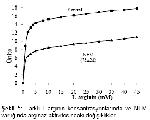
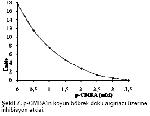
Bu çalışmada NEM ve p-CMBA koyun böbrek doku arginazı üzerine inhibisyon etkileri incelenmiştir. Değişen NEM konsantrasyonlarda enzimin preinkübe edilmesi sonucunda aktivite kaybının 20 mM’da %37, 60 mM’da %72, 100 mM’ da %90, 120 mM da ise %96 ulaştığı saptanmıştır (Şekil 4). Enzim kaynağı, 0,5-3,5 mM değişen konsantrasyonlarda p-CMBA ile preinkübasyona tabii tutulmuştur. p-CMBA 0,5 mM konsantrasyonda koyun böbrek doku arginazını %34, 1 mM’ da %57, 2,5 mM da ise %93 düzeyinde inhibisyona uğratmıştır (Şekil 7). Konsantrasyon 3,5 mM’a ulaştığında ise enzim aktivitesinin %100’ ünü kaybetmiştir.
Enzim aktivitesi 75 mM NEM, 0,75 mM p-CMBA kullanılarak incelenmiş ve veriler Michaelis-Menten grafiği ile değerlendirilmiştir (Şekil 5,8). Grafik verileri Linewear-Burk eğrisine dökülmüş ve Km’leri belirlenmiştir (Şekil 6,9). Her ikisinin de Km’lerinin değişmediği Vmax değerlerinin değiştiği tespit edilmiş ve bu sonuca göre p-CMBA ve NEM’in koyun böbrek doku arginazını nonkompetetif inhibisyona uğrattığı saptanmıştır.
Ber ve ark.29, arginazın aktivite göstermesi için aktif merkezinde, -SH grubu içeren amino asitlerin olması gerektiğini, saflaştırılmış sıçan karaciğer arginazı üzerine p-CMBA ve NEM kullanarak incelemişler ve bu iki maddenin sıçan karaciğer arginazı üzerine inhibisyon etkisi göstermediklerini açıklamışlardır. Buna karşın sığır rumen doku arginazı30 ve insan tiroid doku arginazı üzerinde p-CMBA ve NEM’in inhibisyon etkisinin olduğu bildirilmiştir3.
Helicobacter pylori’nin ligantlarında p-CMBA’in mikromolar düzeyde enzimi inhibe etmesine rağmen27, başka bir çalışmada rat karaciğer arginazının p-CMBA ve NEM’ den etkilenmediği tespit edilmiştir29. M.benedeni arginazı üzerine p-CMBA ve NEM’in inhibisyon etkisinin olduğu ortaya konmuştur31. Bu çalışmada insan tiroid dokusu3 ve rumen dokusunda30 elde edilen bulgulara paralel olarak koyun böbrek doku arginazını p-CMBA ve NEM’ in non kompetetif inhibe ettikleri saptanmıştır.
Sonuç olarak; koyun böbrek doku arginazının aktif merkezinde fonksiyonel –SH gruplarının var olduğu ve katalitik faaliyetin başlaması için –SH gruplarının gerekli olduğu, EDTA, NEM ve p-CMBA’ in enzim aktivitesi üzerinde inhibisyon etkisi gösterdikleri, bu etkiyi de enziminin aktif merkezindeki –SH gruplarını bloke ederek sağladıkları sonucuna ulaşılmıştır.