Skleroderma (sistemik skleroz; SSc), deri ve iç organların yaygın fibrozu ile karakterize, kronik inflamatuar bir hastalıktır
1-3. Hastalığın patogenezi net olarak bilinmemekte, ancak vaskülopati ve immün aktivasyon patogenezde önemli roller almaktadır
1-3. Ek olarak, skleroderma nadir görülen ve klinik olarak heterojen bir hastalıktır
2,4.
Epidemiyoloji
Skleroderma insidans ve prevalansı, etnik ve bölgesel faktörlerle ilişkili olarak, önemli farklılıklar gösterebilmektedir. Hastalık en sık 30-50 yaşlarında görülmektedir ve kadın/erkek oranı 8/1’dir5. Amerika Birleşik Devletleri’nde erişkin populasyonda skleroderma insidans ve prevalansı sırasıyla milyonda 19.3 ve 242 olarak bildirilmiştir6.
Etiyoloji
Sklerodermanın etiyolojisi tam olarak aydınlatılamamasına karşın, genetik ve çevresel faktörler etiyolojiden sorumlu tutulmaktadır.
Skleroderma etiyolojisinde genetik faktörlerin rolü yoğun bir şekilde araştırılmıştır. Birinci derece yakınlarında skleroderma bulunan bireylerde, skleroderma gelişme olasılığı artmaktadır. Normal populasyonda skleroderma gelişme riski % 0.026 iken, birinci derece yakınlarında skleroderma bulunan bireylerde bu risk % 1.6 olarak belirlenmiştir7. İkiz çalışmalarında, düşük klinik konkordans oranı (% 4.7) bildirilmesine karşın, anti-nükleer antikor (ANA) konkordansının çok daha yüksek olduğu (tek yumurta ve çift yumurta ikizlerinde sırasıyla % 90 ve % 40) bildirilmiştir8. Ancak, bu bulgular, hastalığın oluşumunda genetik faktörlerin tek başına sorumlu tutulamayacağını göstermektedir. Transforme edici büyüme faktörü β (TGF-β), monosit kemoatraktant protein 1 (MCP-1), interlökin (IL)-1α, tümör nekroz faktör (TNF)-α, ekstraselüler matriks (ESM) proteinleri (fibronektin, fibrillin vb.), nitrik oksit (NO), endotelin-1 ve anjiotensin dönüştürücü enzim (ACE) genleri araştırılmış ve bu genlerdeki bazı polimorfizmler sklerodermaya duyarlılık ile ilişkilendirilmiştir9.
Silika tozları, vinil klorid, L-triptofan, meme silikon implantları ve organik çözücüler skleroderma ile ilişkilendirilen çevresel faktörlerdir10.
Mesleksel uğraşılar nedeniyle vinil klorid ile karşılaşan işçilerin çoğunda Raynaud fenomeni (RF) ve sklerodermaya özgü deri bulguları gözlenmektedir11.
1980’li yıllarda, İspanya’da epidemik toksik yağ sendromu ve ilerleyen yıllarda Amerika Birleşik Devletleri’nde görülen L-triptofan kullanımı ile ilişkilendirilen eozinofili-miyalji sendromunun deri bulguları, skleroderma ile benzerlikler göstermektedir10. Diğer birçok çevresel ve mesleksel faktörlerin skleroderma ile ilişkileri araştırılmasına karşın, bu risk faktörlerinin birçok hastada bulunmayışı skleroderma etiyopatogenezinden tek başlarına sorumlu tutulamayacaklarını düşündürmektedir10.
Çeşitli bakteriyel ve/veya viral enfeksiyöz ajanların (helikobakter pilori, sitomegalovirüs [CMV], parvovirus B19, Epstein-Barr virus [EBV] ve retroviruslar) skleroderma etiyolojisinde rol alıyor olabileceği bildirilmiştir12. Skleroderma hastalarında, CMV spesifik antikorların artmış olduğu ve bu virusun deney hayvanlarında skleroderma vaskülopatisine benzer vasküler lezyonlara yol açtığı gösterilmiştir13,14. Sağlıklı insanlarda % 0.6 sıklığını aşmayan parvovirus B19 varlığı, skleroderma hastalarında % 4 sıklığında belirlenmiş15 ve kemik iliği biyopsilerinde ise çok daha yüksek sıklıkta (% 57) saptanmıştır16. Skleroderma hastalarında, helikobakter pilori seroprevalansının da yüksek olduğu (% 78) gösterilmiştir17. Enfeksiyöz ajanlar, moleküler benzerlik ve/veya direkt endotelyal hücre hasarı yaparak, skleroderma etiyopatogenezine katkı yapıyor olabilir12.
Skleroderma hastalarının kanlarında ve deri lezyonlarında, fetal orjinli mikrokimerik hücrelerin artmış olduğu gözlenmiştir18,19. Skleroderma, kadınlarda erkeklerden yaklaşık 8 kat daha sık görülmekte ve çoğu hastada doğurganlık çağı sonrasında başlamaktadır5. Allojenik transplantasyonları izleyen komplikasyonlardan olan graft-versus-host hastalığı ile skleroderma arasında histolojik, patogenik ve klinik benzerlikler olması, skleroderma etiyopatogenezinde mikrokimerizmin rol oynayabileceğini düşündürmektedir18. Ancak, sağlıklı bireylerde bile mikrokimerik hücrelerin saptanması, bazı hastalarda mikrokimerik hücrelerin bulunmayışı, hastalığın başlangıcından önce hiç gebeliği olmayan kadın hastaların varlığı ve erkeklerde de hastalığın görülmesi, mikrokimerizmin SSc etiyopatogenezindeki rolü açısından soru işaretleri taşımaktadır18.
Patogenez
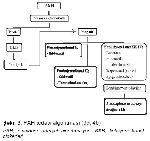
İmmün aktivasyon ve vaskülopati (endotelyal hiperaktivasyon) sonucu fibroblastik aktivasyon ve ESM yapımında artış ve ESM degradasyonunda azalma, skleroderma patogenezinin temel özellikleri (Şekil 1) olduğu bilinmesine karşın1-3,20, sklerodermanın patogenezi tam olarak aydınlatılamamıştır.

Büyütmek İçin Tıklayın |
Şekil 1: Sklerodermadaki temel patolojik özelliklerin hastalığın zamanla değişen fenotipine katkıları |
Patogenezin endotelyal hücre hasarı ve immün aktivasyon bölümü için, genetik ve çevresel faktörler ve mikrokimerizm tetikleyici risk faktörleri olarak belirtilmektedir (Şekil 2)20.
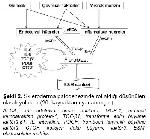
Büyütmek İçin Tıklayın |
Şekil 2: Skleroderma patogenezinde rol aldığı düşünülen olasılı yolaklar (20. kaynaktan uyarlanmıştır)
AECA; anti-endotelyal hücre antikoru, MCP-1; monosit kemoatraktan protein-1, TGF-β1; transforme edici büyüme faktörü-β1, IL; interlökin, PDGF; trombosit kaynaklı büyüme faktörü, CTGF; kollojen doku büyüme faktörü, ESM; ekstraselüler matriks |
Vaskülopati ile ilişkili RF ve kapilleroskopik anormallikler sklerodermanın öncül bulgularındandır ve preklinik dönemde bile saptanabilmektedir. Bu durum, vaskülopatinin skleroderma patogenezindeki önemini ortaya koymaktadır. Vaskülopati, endotelyal hasar sonucu, inflamatuar hücrelerin adezyonuna ve migrasyonuna neden olmaktadır ve fibrointimal proliferasyon ve epizodik vazospazmlar ile karakterizedir21. Bu proliferasyonun nedeni net olarak bilinmemektedir, ancak dokularda iskemi ile sonuçlanmaktadır.
Endotelyal hücre kültürlerine fibroblast büyüme faktörü-122 veya TNF-α ve IL-1β gibi proinflamatuar sitokinler eklendiğinde23, endotelyal hücrelerin miyofibroblastik hücrelere dönüştüğü bildirilmiştir. Bir oksidan olan homosisteinin de endotelyal-miyofibroblastik hücre dönüşümünü tetiklediği gösterilmiştir24.
İmmün aktivasyon kanıtları, vaskülopatide olduğu gibi, deri fibrozu oluşmadan önce gösterilebilmektedir13,25. Skleroderma hastalarının deri lezyonlarının histopatolojik incelenmesinde T lenfositler, makrofajlar, mast hücreleri ve daha az oranda B lenfosit infiltrasyonları saptanmıştır13.
Sklerodermada IL-4, TGF-β ve IL-17 gibi T lenfosit aracılı sitokinler ve T lenfosit aktivasyon belirteçlerinden olan IL-2 reseptör ekspresyonunun arttığı bilinmektedir. Aktive olan T lenfositler, CD154/CD40 ligandı aracılığı ile fibroblastlara bağlanarak doğrudan veya IL-4 ve TGF-β gibi profibrotik sitokinler aracılığı ile dolaylı olarak fibroblastik aktivasyona ve sonuçta kollajen, fibronektin gibi ESM yapıtaşlarının sentezinde artışa neden olmaktadır13,20. IL-17, endotelyal hücrelerden interselüler hücre adezyon molekülü-1 (ICAM-1), vasküler hücre adezyon molekülü-1 (VCAM-1) gibi adezyon moleküllerinin üretimini artırarak, inflamatuar hücre infiltrasyonuna katkı sağlamaktadır13,20.
Fibroblastik aktivitenin temel indükleyici faktörlerinden birisi olan TGF-β, fibroblastlardan, in vivo ve in vitro olarak, kollajen gibi ESM yapıtaşlarının üretimini artırmaktadır26,27. Aktive fibroblastlar (miyofibroblastlar), ESM yapıtaşlarının sentezi yanında, IL-6, TGF-β1, trombosit kaynaklı büyüme faktörü (PDGF) ve kollajen doku büyüme faktörü (CTGF) gibi pro-fibrotik sitokin ve büyüme faktörlerini de üretirler13,20. Böylece, fibroblastlar bir kez aktive olduktan sonra otokrin özellik kazanmakta ve aktivasyon için inflamatuar hücre uyarımına gereksinimleri kalmamaktadır13,20.
Bcl-2 ailesi transkripsiyon faktörleri, oldukça kompleks düzenleyici mekanizmalara sahip olan apoptozun önemli inhibitör düzenleyicileridir28,29. Skleroderma hastalarında dermal fibroblastların apoptoza dirençli oldukları gösterilmiş ve bu durum artmış bcl-2 ekspresyonu ile ilişkilendirilmiştir30. Ek olarak, Cipriani ve ark.31 skleroderma hastalarında α/β ve γ/δ T lenfositlerin apoptoza dirençli olduklarını bildirmişlerdir.
Sklerodermada hastalığa özgü otoantikorların saptanması, otoantikor tipi ile hastalık fenotipleri arasındaki ilişki (Tablo 1) ve hipergamaglobulinemi, B lenfositlerin skleroderma patogenezindeki rolüne işaret etmektedir. Diğer taraftan, sklerodermada B lenfosit homeostazında değişiklik, poliklonal hiperaktivasyon, duyarlı B lenfositlerde artış ve hafıza B lenfositlerde azalma olduğu gösterilmiştir32. Ek olarak, endotelyal hasara yol açan anti-endotelyal hücre antikoru B lenfositler tarafından üretilmektedir.

Büyütmek İçin Tıklayın |
Tablo 1: Sklerodermaya özgü otoantikorlar ve bu otoantikorların skleroderma alt grupları ve klinik bulgular ile ilişkileri. |
Ekstraselüler matriks elamanlarının yapımı ve yıkımı dinamik bir denge halinde olup, bu dengenin yapım lehine bozulması fibroz ile sonuçlanmaktadır33,34. ESM degradasyonu matriks metalloproteinaz (MMP)’lar ile sağlanmaktayken, doku MMP inhibitörleri (tissue inhibitor of metalloproteinases [TIMPs]) bu dengeyi fibrogenez lehine kaydırmaktadır33,34. Sklerodermada MMP-1, 3 ve 13 düzeylerinin ve aktivitelerinin azaldığı, TIMP-1, 2 ve 3 üretiminin ise arttığı gösterilmiş ve MMP/TIMP dengesinin bozulduğu ileri sürülmüştür33,34.
Klinik
Skleroderma klinik bulgularına göre, lokalize ve sistemik skleroderma olarak iki alt gruba ayrılır. Lokalize formlarda (Tablo 2), sistemik sklerodermadan farklı olarak RF, yapısal vasküler zararlanmalar (dijital ülserler, pulmoner arteryel hipertansiyon [PAH] vb.), otoimmün belirteçlerde olumluluk ve iç organ tutulumları bulunmamaktadır. En sık görülen lokalize skleroderma formu olan morfea, morfolojik paterni ve etkilenen deri dokusunun genişliğine göre alt gruplara ayrılmaktadır (Tablo 2).
Sistemik formlarda (Tablo 2), deri tutulumuna vaskülopati, otoimmünite kanıtları veya iç organ tutulumlarına ilişkin klinik bulgular eşlik etmektedir. Hastalardaki ilk yakınmalar ve klinik bulgular çoğu zaman nonspesifiktir. RF, halsizlik-yorgunluk ve kas-iskelet sistemi yakınmaları başlıca klinik bulgulardır. Bu klinik bulgular haftalar-aylar boyunca devam edebilir. İlk spesifik bulgu, el ve parmak derisindeki şişlik ve sertleşmedir. Bu aşamadan sonraki klinik seyir oldukça değişkendir. Klinikte en sık karşılaşılan sistemik formlar olan difüz cilt tutulumlu SSc (dcSSc) ve sınırlı cilt tutulumlu SSc (lcSSc), temel olarak cilt tutulumunun lokalizasyon ve genişliğine göre ayrılmış olmakla birlikte, pekçok yönüyle farklılıklar göstermektedirler. Pre-skleroderma ve sklerodermasız skleroderma (scleroderma cine scleroderma) nadir karşılaşılan diğer sistemik klinik formlardır (Tablo 2). Pre-skleroderma, tipik deri tutulumu olmaksızın, RF’ne sklerodermaya özgül otoantikorların olumluluğu veya tırnak yatağı kapilleroskopik anormalliklerinin eşlik ettiği bir klinik formdur. Sklerodermasız sklerodermada ise deri tutulumu bulunmaksızın, tipik iç organ tutulumları gözlenmektedir.
Sınırlı cilt tutulumlu sklerodermada, deri tutulumu, gövde tutulumu olmaksızın, ekstremitelerin distal kısımlarına yerleşiktir. RF, lcSSc hastalarının çoğunda, deri tutulumundan ortalama 5-10 yıl önce başlamaktadır. lcSSc’da, dcSSc ile karşılaştırıldığında, iç organ tutulumları daha az görülmekte veya daha geç dönemde ortaya çıkmaktadır. lcSSc’un sık karşılaşılan klinik bulguları kalsinoz, RF, özefagus dismotilitesi, sklerodaktili ve telenjiektazi olup, bu bulgular CREST sendromu olarak isimlendirilmiştir. Ek olarak, interstisyel akciğer fibrozu (ILD) bulunmaksızın gelişen PAH, lcSSc’un önemli bir komplikasyonudur. lcSSc’da sıklıkla anti-sentromer antikor pozitifliği vardır ve prognozu dcSSc’dan daha iyidir.
Cilt tutulumunun ekstremitelerin proksimaline ve gövdeye kadar ilerlediği form, dcSSc olarak adlandırılmaktadır. lcSSc’dan farklı olarak, dcSSc’da RF ile deri tutulumunun başlangıcı arasındaki süre daha kısadır. Bu hastalarda, sıklıkla anti-sentromer antikor negatif, anti-topoizomeraz-I (anti-scl-70) antikoru ise pozitiftir. dcSSc’da, iç organ tutulumu (akciğer, kalp, böbrek ve gastrointestinal sistem) daha sıktır ve prognoz daha kötüdür. Akciğer tutulumunun bir formu olan ILD, başlangıçta efor dispnesi ve non-prodüktif öksürük ile kendini gösterir. Alveollerdeki inflamasyon ve fibrotik proçesi interstisyel fibroz izler ve mortalitesi yüksektir. Kalp tutulumu en sık perikardit şeklinde olup, belirgin semptomlara neden olmayabilir. Miyokard tutulumu efor dispnesi, çarpıntı ve göğüs ağrısına neden olabilir. Gastrointestinal sistem tutulumunda en sık yutma güçlüğü, pirozis, özefageal reflü ve özefajit gözlenir. İnce barsak tutulumu varlığında ise obstrüksiyon, distansiyon, karın ağrısı, ishal ve malnütrisyon belirlenebilir.
Skleroderma, bir veya daha fazla bağ dokusu hastalığı ile birlikte görülebilir ve bu durumlar çakışma sendromu olarak adlandırılır.
Tedavi
Günümüzdeki tedavi yaklaşımları sklerodermanın bazı bulgularını kontrol altına alıyor olsa da skleroderma için uluslararası düzeyde kabul edilmiş bir tedavi protokolu bulunmamaktadır36. Skleroderma tedavisi, tutulan organ sistemlerine ve klinik bulguların ağırlığına göre düzenlenmelidir. Bu nedenle, tedavi planlanırken hastaların organ-sistem tutulumları açısından dikkatli bir şekilde değerlendirilmesi gerekmektedir.
Periferik vasküler sistem tutulumunda tedavi: Vasküler sistem tutulumunda tedavideki temel hedefler RF sıklığını azaltmak, iskemik-ülsere lezyonların iyileşmesini hızlandırmak ve progresif tıkayıcı damar hasarını yavaşlatmaktır. RF olan hastaların soğuk, stres ve sigara kullanımından kaçınmaları, ekstremitelerini sıcak tutmaları ve gerekmedikçe vazospastik ilaç kullanmamaları gerekmektedir. RF tedavisinde dihidropiridin grubu kalsiyum kanal blokerleri (KKB), ACE inhibitörleri ve anjiotensin reseptör blokerleri gibi vazodilatatör ilaçların yararlı oldukları kanıtlanmıştır. KKB, bu amaçla en sık kullanılan vazodilatatörlerdir. Ancak, yararları sınırlıdır ve palpitasyon, hipotansiyon gibi yan etkileri bulunmaktadır. ACE inhibitörlerinin etkinliğini araştıran yeterli çalışma bulunmamaktadır. Yukarıdaki tedavi ajanları ile yakınmaların kontrol altına alınamadığı veya kontrendikasyonlar nedeniyle kullanılamadığı durumlarda α-reseptör blokerleri, fosfodiesteraz tip 5 (PDE-5) inhibitörleri, fluoksetin gibi seratonin geri alınım inhibitörleri, topikal nitrogliserin veya intravenöz (iv) prostaglandin analogları kullanılabilmektedir36,37.
Yaşam şekli değişikliği önerileri ve vazodilatatör ilaçların kullanımına karşın yakınmaları devam eden hastalarda, sempatektomi diğer bir tedavi seçeneğidir. Şiddetli RF olanlarda, iskemik parmak ülserleri önemli bir sorundur. Dijital ülserler nedeniyle başvuran hastalarda ve klasik tedavi yöntemlerine dirençli RF varlığında, klasik tedavi yaklaşımlarına ek olarak, iv iloprost kullanılabilmektedir36,37.
Gastrointestinal sistem tutulumunda tedavi: Gastro-özefageal yakınmaları olan hastalarda, kanıt düzeyi yüksek çalışmalar bulunmamasına karşın, karyola baş kısmının yükseltilmesi ve uygun diyet yaklaşımları (sık ve az miktarlarda yemek vb.) gibi yaşam şekli değişiklikleri ve proton pompa inhibitörleri kullanılabilir36. Metoklopramid ve eritromisin gibi prokinetik ilaçlar, üst gastrointestinal sistem motilitesini artırmak için kullanılabilir. Bu amaçla yapılmış bir çalışmada, sisapridin etkili olduğu ortaya konulmuş38, ilerleyen yıllarda ise uzun QT sendromu ve aritmilere yol açması nedeniyle sisaprid kullanımdan kaldırılmıştır. Özefagus darlıkları için periyodik endoskopik dilatasyonlar yapılabilir. Alt gastrointestinal sistem semptomları varsa ve bu durum bakteriyel çoğalma ile ilişkilendirilirse, kinolonlar veya amoksisilin-klavulanik asit gibi geniş spektrumlu antibiyotikler kullanılabilir36.
İnterstisyel akciğer fibrozunda tedavi: Sklerodermanın pulmoner tutulumları kabaca ILD ve PAH olarak iki gruba ayrılabilir. ILD saptanan hastalarda immünsüpresif ilaçlar etkili olabilmektedir36. Bu açıdan, randomize kontrollü çalışmalarda değerlendirilmiş olan tek immünsüpresif ilaç siklofosfamid olup Avrupa Romatizma Birliği (EULAR) tarafından skleroderma hastalarında gelişen ILD tedavisinde önerilmiştir. EULAR, aktif ILD saptanan hastalarda, siklofosfamidin oral 1-2 mg/kg/gün veya iv 600 mg/m2/ay dozlarda uygulanmasını, hastalık aktivitesi kontrol altına alındıktan sonra ise idame tedavisi olarak 2.5 mg/kg/gün dozunda azatioprin kullanımını önermiştir. Ancak, siklofosfamid lökopeni, enfeksiyonlara yatkınlık, hemorajik sistit, alopesi ve infertilite gibi yan etkiler yapabilmektedir. Ek olarak, siklofosfamid mesane kanseri vb. ikincil maligniteler ile ilişkilendirilmektedir.
Pulmoner arteryel hipertansiyon tedavisi: Sklerodermaya ikincil PAH tedavisinde, öncelikli olarak hastaların fonksiyonel durumunun belirlenmesi (Tablo 3) ve vazoreaktivite testi yapılması gerekmektedir. Vazoreaktivite testinde, kısa etkili bir vazodilatatör (inhale iloprost veya NO veya iv adenozin veya epoprostenol) uygulandığında, kardiyak debide değişim olmaksızın, ortalama pulmoner arter basıncında ≥ 10 mmHg düşüş olursa test pozitif olarak yorumlanmaktadır39. Vazoreaktivite testi pozitif olan hastaların oral KKB tedavisine duyarlı oldukları gösterilmiştir. Ancak, idiopatik PAH hastalarının sadece % 13’ünde bu test pozitif bulunur ve bunların da sadece yarısı KKB tedavisinden yararlanmaktadır39. Vazoreaktivite testi negatif olan veya 3-6 aylık KKB tedavisine yanıt vermeyen hastalar, fonksiyonel durumlarına göre, daha uygun diğer ajanlar ile tedavi edilmelidir (Şekil 3)40. Bu durumda prostasiklin analogları, endotelin reseptör antagonistleri ve PDE-5 inhibitörleri PAH tedavisinde kullanılabilecek tedavi ajanlarıdır39. Prostasiklin analoglarından iloprost, epoprostenol ve treprostinilin egzersiz kapasitesi, dispne skoru, kardiyopulmoner hemodinamiler ve yaşam süresine olumlu etkileri bildirilmiştir. Ancak, epoprostenol sürekli iv olarak uygulanılmakta ve infüzyon paketinin de devamlı soğutulması gerekmektedir (epoprostenolün ısıya duyarlı olması nedeniyle). Ek olarak, infüzyonun kesilmesi durumunda şiddetli ve ani pulmoner ödem gelişebilmektedir. Ayrıca, baş ağrısı, çene ağrısı, bulantı-kusma ve abdominal kramplar görülebilmektedir39. Benzer yan etkiler gösteren diğer bir prostasiklin analoğu olan treprostinil, subkutan (sc) veya iv olarak uygulanabilmekte ve soğutma işlemine gereksinim bulunmamaktadır (ısıya duyarlı olmaması nedeniyle) ve iv uygulama sc uygulamaya göre daha az yan etki oluşturmaktadır39. İloprost, kliniğimizde de kullanımda olan bir prostasiklin analoğu olup, inhalasyon şeklinde uygulanması daha az sistemik yan etki oluşturmaktadır. Oral prostasiklin analoğu olan beraprosta ilişkin çalışmalar halen devam etmektedir.
Bosentan, sitaksentan ve ambrisentan, güçlü bir vazokonstriktör ve düz kas mitojeni olan endotelin-1’in reseptör antagonistleridirler39. Endotelin-1, etkilerini ETA ve ETB olarak bilinen iki reseptör üzerinden gerçekleştirmektedir. Ancak, ETB reseptörünün rolü henüz tartışmalıdır. Bosentan, her iki endotelin-1 reseptörünün, sitaksentan ve ambrisentan ise spesifik olarak ETA reseptörünün antagonistleridir. Bosentan, hastalarda egzersiz kapasitesi, pulmoner vasküler direnç ve pulmoner arter basıncı üzerine olumlu etkiler göstermektedir. En sık gözlenen yan etkisi hepatotoksisitedir ve yaklaşık olarak % 5-10 hastada karaciğer fonksiyon testlerinde normalin 3 katı veya daha fazla artışa neden olabilmektedir39. Endotelin-1 reseptör antagonistlerinin etkileri yavaş ortaya çıktığından, ileri evrelerdeki ve hemodinamik olarak stabil olmayan hastalarda ilk tercih olmamalıdır39.
Nitrik oksit, vazodilatatör etkisini hücre içi siklik guanozin monofosfat (cGMP) üzeriden göstermektedir. Akciğer dokusunda da yoğun olarak bulunan PDE-5, cGMP’ı hızlı bir şekilde inaktive etmektedir. PDE-5 inhibitörü olan sildenafil, cGMP ve böylece NO üzerinden pulmoner vasküler yapılarda vazodilatatör etki göstermektedir. Sildenafil kullanımında en sık karşılaşılan yan etki baş ağrısıdır ve genellikle iyi tolere edilebilmektedir39.
Pulmoner arteryel hipertansiyona ikincil son dönem sağ kalp yetmezliği geliştiğinde ve kombine tedavilere karşın hastanın yakınmaları kontrol altına alınamadığında atrioseptostomi, kalp-akciğer veya sadece akciğer transplantasyonu uygun seçeneklerdir36.
Renal krizde tedavi: Malign hipertansiyon ve hızlı ilerleyen böbrek yetmezliği bulguları ile seyreden renal kriz, sklerodermanın en önemli komplikasyonlarından birisidir. Renal kriz önemli derecede mortal olup, 1 ve 5 yıllık sağ kalım oranları sırasıyla % 15 ve % 10 olarak bildirilmiştir41. Yüksek cilt skoru (modifiye Rodnan deri kalınlık skoru ≥ 20), eklem kontraktürleri varlığı ve kortikosteroid kullanımı renal kriz gelişimi açısından risk faktörleri olarak belirlenmiştir42. Renal kriz riski yüksek olan hastalar, kan basıncı ve renal fonksiyonlar açısından daha sık ve düzenli olarak izlenmelidir36.
Renal kriz tedavisinde ACE inhibitörleri ilk seçilecek ilaçlardır. Kaptopril ve enalapril, sağ kalım oranlarını önemli derecede artırmış (1 ve 5 yıllık sağ kalım oranları sırasıyla, tedavi grubunda % 76 ve % 66, plasebo grubunda % 15 ve % 10 olarak belirlenmiştir) ve kalıcı diyalize gereksinim duyan hasta sayısını azaltmıştır41. Bazı hastalarda, tüm tedavi yaklaşımlarına karşın, geçici ve/veya kalıcı diyaliz ve sonuçta böbrek transplantasyonu gerekebilmektedir.
Kalsinoz tedavisi: Sklerodermada % 25 sıklıkta karşılaşılan kalsinoz, tekrarlayan mikrotravmalara uğrayan ön kol, dirsekler ve parmaklar gibi bölgelerde gözlenmektedir ve lcSSc formunda daha sık bulunmaktadır. Kalsinoz, yerleştiği bölgelerde deriyi hasarlayarak, ülsere lezyonlara ve ikincil enfeksiyonlara neden olmaktadır43. Değişik çalışmalarda, kalsinoz tedavisinde warfarin, minosiklin, alüminyum hidroksit, aspirin, kolşisin, probenesid, bifosfonatlar ve diltizemin etkinlikleri araştırılmıştır. Ayrıca, yüzeyel ve küçük kalsinozlarda karbondioksit lazer tedavisi, büyük kalsinozlarda ise cerrahi işlemler uygulanabilmektedir. Ancak, bu tedavi yaklaşımlarından hiçbiri kalsinozun önlenmesi ve tedavisinde standart tedavi olarak kabul edilmemektedir43.
Cilt tutulumunun tedavisi: Günümüzde, yerleşmiş fibroz tedavisinde kullanılabilecek olan onay almış herhangi bir temel etkili ilaç bulunmamaktadır37. Skleroderma deri fibrozunun tedavisi, bu hastalık ile ilgilenen klinisyenlerin önünde önemli bir sorun olarak kalmaya devam etmektedir. Uzun yıllardır kullanılmakta olan D-penisilaminin ise etkisi tartışmalıdır44,45. Kortikosteroidler, hastalık progresyonu üzerine etkili değildir37. Ek olarak, kortikosteroidler renal krizi de provake edebilmektedir. Sklerodermada azatioprin, klorambusil ve 5-florourasil gibi immünsüpresifler etkisiz bulunmuştur46,47. Metotreksat ile yapılmış çalışmalarda48,49 kısmi bir etki rapor edilmiş ve bu bulgular doğrultusunda metotreksat EULAR’nin skleroderma tedavi önerilerinde yerini almıştır36. Ancak, klinik pratikte metotreksat tedavisinin etkili olmadığı gözlenmektedir. Kliniğimizde yapılmış olan deneysel bir çalışmada da metotreksat tedavisinin dermal fibroz üzerine olumlu etkisinin bulunmadığı ortaya konulmuştur50.
Sklerodermaya ikincil ILD tedavisinde başarı ile kullanılmakta olan siklofosfamidin, küçük gözlemsel çalışmalarda, hastaların cilt skorlarını da düzelttiği rapor edilmiştir51. Retrospektif bir çalışmada, mikofenolat mofetilin deri fibrozu üzerine olumlu etkileri ortaya konulmuştur52. Ancak, mikofenolat mofetilin skleroderma deri tutulumuna etkilerinin değerlendirildiği daha ileri çalışmalara gereksinim vardır. Biyolojik tedavi ajanlarından rituksimabın ise skleroderma deri tutulumunda etkili53 ve etkisiz olduğu54 çalışmalar bulunmaktadır.
Tartışma
Skleroderma nadir görülen, klinik olarak heterojen, deri ve iç organların yaygın fibrozu ile seyreden kronik inflamatuar bir hastalıktır2,4. Böylece, patogenezin tam olarak aydınlatılması ve etkin tedavi protokollerinin standardizasyonu oldukça zor olmaktadır. Günümüzde, skleroderma için uluslararası düzeyde kabul edilmiş bir tedavi protokolu bulunmamasına karşın, son gelişmeler doğrultusunda, sklerodermanın renal kriz, PAH, ILD gibi klinik bulguları kontrol altına alınabilmektedir. Klinik bulgular, iç organ tutulumları ve hastalık seyrinin her hasta için farklılıklar gösterebilmesi nedeniyle, skleroderma hastalarında tedavi planlanırken hastaların organ-sistem tutulumları açısından dikkatli bir şekilde değerlendirilmesi ve tedavi protokollerinin klinik bulgular temelinde düzenlenmesi gerekmektedir.