Glikoproteinler polipeptid iskeletlerine kovalent olarak bağlı oligosakkarit (glikan) zincirlerini içeren proteinlerdir
1-4. Glikoproteinler glikokonjugatların veya karma karbonhidratların bir sınıfıdır. Kompleks karbonhidratların üç sınıfı olan glikoproteinler, proteoglikanlar ve glikolipidler genellikle hep birlikte “Glikokonjugat “ olarak adlandırılır. Doğada yaygın Şekilde bulunan şeker zincirlerinin yapılarını, biyosentezlerini ve biyolojik görevlerini araştıran moleküler biyoloji dalına ise “Glikobiyoloji” denir
5-7. Modern biyoteknolojide glikobiyolojinin önemi her geçen gün daha iyi anlaşılmaktadır. Biyolojik aktif doğal moleküllerin çoğu glikokonjugatlar olup, şekerler bağlı oldukları moleküllerin sentezi, parçalanması, kararlılığı ve aktifleşmesinde çok önemli etkilere sahiptir
7.
Glikoproteinlerin Yapısı
Glikoproteinlerin karbonhidrat kısmında başlıca 7 çeşit monosakkarid bulunur. Bu monosakkaridler, değişik sıralama ve farklı bağ yapıları ile bir araya gelirler ve sonuçta çok sayıda karbonhidrat zinciri yapısı ortaya çıkar. Glikoproteinlerde yer alan monosakkaridler; glikoz, galaktoz, mannoz, fukoz, N-asetil glikozamin, N-asetil galaktozamin, N-asetilnöraminik asit (sialik asit)'tir. Bunlardan başka daha az sıklıkla rastlanan arabinoz ve ksiloz vardır 8. Oligosakkarit zincirleri glikoproteinlerin peptid omurgasına 5 ayrı amino asit artığının birinden bağlanmışlardır. Bunlar; asparajin, serin, treonin, hidroksilizin veya hidroksipirolindir 2, 4, 9-11.
Glikoproteinlerin Sınıflandırılması
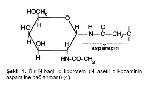
İçerdikleri bağ tipine göre glikoproteinler, N-glikozidik bağı içerenler ve O-glikozidik bağı içerenler olmak üzere 2 ana sınıfa ayrılır. N-glikozidik bağı içeren glikoproteinlerde şeker asparajin yan zincirinin amid grubuna bağlanır (Şekil 1). Ovalbumin, immunglobulinler, orosomukoid başlıca N-bağlı glikoproteinlerdir.
N-bağlı glikoproteinlerde karma, mannozdan zengin ve melez oligosakkaritler olmak üzere 3 ana sınıf oligosakkarit bulunur. Her 3 sınıf glikoproteinde de ortak bir pentasakkarit çekirdek bulunur. (Man3 Glc NAc2) Bu ortak pentasakkaritin varlığı bunların biyosentezlerinde ortak bir başlangıç mekanizmasının bulunması ile açıklanır 4, 12. Karma tip glikoproteinler genellikle uç NeuAc kalıntıları ile tabanda yatan Gal ve GlcNAc kalıntıları içerir. Karma glikoproteinler hayvan glikoproteinlerinde bulunur. 100'den fazla tipinin belirlenmiş olması kimyasal işaretleme ve tanıma olaylarında karbonhidratların farklılığını gösterir 13. Mannozdan zengin oligosakkaritler tipik olarak, pentasakkarit çekirdeğe bağlı 2-6 ek mannoz kalıntısı içerirler. Bütün N-bağlı oligosakkaritler başlangıçta mannozdan zengin yapılar halinde oluşurlar, daha sonra farklı tipte kompleks oligosakkaritlere farklılaşırlar. Bunlar hayvan glikoproteinleri içinde sınırlı sayıda yer alırlar. Daha çok düşük ökaryotlarda ve viral zarf glikoproteinlerinde bulunurlar. Melez oligosakkaritler ise diğer iki sınıfın her ikisine ait nitelikleri taşırlar 14, 15.
N-bağlı glikoproteinler glikoproteinlerin ana sınıfını oluşturur. Kolayca erişilebilen proteinler (örn. Plazma proteinleri) esas olarak bu gruba ait oldukları için bu glikoproteinler daha fazla incelenmiştir. Bu grupta hem zara bağlı hem de dolaşımda yer alan glikoproteinler bulunur.
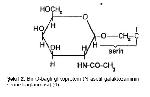
O-glikozidik bağı içeren glikoproteinlerde, şeker serin veya treoninin R grubunun hidroksiliyle bağlanır (Şekil 2). Birçok membran proteini, müsinler, proteoglikanlar, kollajenler başlıca O-bağlı glikoproteinlerdir 7,11.
Glikoproteinler başlıca memeli glikoproteinleri, balık glikoproteinleri, bitki glikoproteinleri, bakteri glikoproteinleri, viral glikoproteinler ve paraziter glikoproteinler olarak da sınıflandırılabilirler 16.
Glikoproteinlerin Biyosentezi Nerede Gerçekleşir?
N- ve O-bağlı glikoproteinlerin sentezi endoplazmik retikulumun lümeninde ve golgide gerçekleşir. O-bağlı glikoproteinlerin sentezi sırasında lipid taşıyıcılar olaya katılmazken N-bağlı glikoproteinler lipid yapısında olan dolikol ve onun fosforile türevi olan dolikol pirofosfata gereksinim gösterirler 1, 9, 17, 18. N-glikolizasyon olayı 2 evreye ayrılabilir:
1. Oligosakkarit P-P dolikol'ün bir araya gelmesi ve aktarılması
2. Oligosakkarit zincirinin işlemlenmesi
O-bağlı oligosakkaritlerin sentezi ise şeker nükleotidlerden şekerlerin basamak basamak eklenmesi ile golgi'de gerçekleşir. Lipid taşıyıcılar olaya katılmaz 11.
Glikozilfosfatidilinozitol (GPI) Bağlı Glikoproteinler
Glikozilfosfatidilinozitol bağlı glikoproteinler glikoproteinlerin üçüncü büyük sınıfını oluşturur. GPI bağlı glikoproteinler plazma zarının dış katmanına fosfatidilinozitolün (PI) yağ asitleri ile tutunur. PI, bir Glc-NH2 parçası yoluyla, çeşitli şekerler içeren bir glikan zincirine bağlanır. Oligosakkarit zinciri daha sonra fosforiletanolamin yoluyla bir amid bağı ile bağlanan proteinin karboksil ucuna bağlanır. GPI çatılarının çoğu bir molekül fosforiletanolamin, üç Mannoz kalıntısı, bir molekül GlcNH2 ve bir molekül fosfatidilinositol içerir 2, 4, 12. Bazı GPI bağlı proteinler; Asetilkolinesteraz (alyuvar zarı), alkalen fosfataz (barsak, plasenta), yıkım hızlandıran faktör (alyuvar zarı), 5'-Nükleotidaz (T lenfositler), Thy-1 antijeni (beyin, T lenfositler), Değişken yüzey glikoproteinleri (Trypanosoma brucei) 4'dir.
Glikoproteinleri İncelemede Kullanılan Başlıca Önemli Yöntemler 4, 19
Kromatografik yöntemler: Bunlardan en önemlileri İnce Tabaka Kromatografisi (Thin Layer Chromatography) (TLC), Yüksek Performanslı Sıvı Kromatografisi (High Performance Liquid Chromatography) (HPLC), Gaz Kromatografisi (Gass Chromatography) (GC) dir.
Lektin Affinite Kromatografisi: Kullanılan özgül lektine bağlanan glikoproteinler ve glikopeptidleri saflaştırmak için kullanılır.
NMR Spektroskopi: Özgül şekerlerin dizgisinin, bağlarının ve glikozid bağlarının anomer doğasının kimliklendirilmesinde yararlanılır.
Kütle Spektroskopisi: Molekül kütlesi, bileşimi, dizgisi ve bazen bir glikan zincirinin dallanması hakkında bilgi verir. Fast Atom Bombardment Mass Spectrometry (FAB-MS), - Matrix-Assisted Laser Desorption/Ionisation Time-of-Flight Mass Spectrometry (MALDI-TOF MS), Electrospray Ionisation Mass Spectrometry (ESI-MS).
Periodik Asit-Schiff Ayıracı: Elektroforetik ayırımdan sonra glikoproteinleri pembe bantlar halinde gösterir.
Kültür Hücrelerinin Radyoaktif Şekerle İnkübasyonu: Elektroforetik ayırımdan sonra glikoproteinlerin radyoaktif bantlar halinde saptanmasını sağlar.
Uygun Glikozidaz veya Fosfolipazla İşlemleme: Elektroforetik göçte oluşan kayma N-glikan, O-glikan veya GPI bağlarına sahip proteinler arasında ve büyük miktarda mannoz ve N-glikanlar arasında ayırım yapmaya yardım eder.
Metilasyon Analizi: Şekerler arasındaki bağların belirlenmesini sağlar
Amino Asit veya cDNA Dizgi Analizi: Amino asit dizisinin belirlenmesini sağlar.
Glikoproteinlerin Oligosakkarit Zincirlerinin Fonksiyonları
Glikoproteinlerin yapısındaki şekerlerin en önemli görevleri moleküller ve hücreler arası tanıma olaylarında görülür 7, 20, 21. Bundan başka;
• Hücre içinden ve dışından gelen proteolize karşı korunma sağlar
• Öncül proteinlerin daha küçük ürünlere proteolitik işlemlenmesini etkiler
• Fizikokimyasal nitelikleri (örn: çözünürlük, akışkanlık, yük ve denaturasyon) değiştirir
• Biyolojik etkinliğe katılır (örn: koriyonik ganadotropini)
• Zarlara yerleşmeyi, hücre içi göçü, sınıflandırılmayı ve salgılamayı etkiler
• Embriyonik gelişmeyi ve farklılaşmayı etkiler
• Kanser hücreleri tarafından seçilen metastaz noktalarını etkiler 4, 11.
N-bağlı oligosakkaritlerin en önemli görevleri protein katlanması sırasındadır. Endoplazmik retikulumdaki “şaperon” adı verilen proteinler yeni sentezlenen membran proteinlerinin doğru konformasyonda katlanmalarına yardım ederler 18. Şaperonlar, polipeptidlerin biyosentezleri sırasında katlanmaları ile organellere transportunu kolaylaştıran ve hücresel stres koşullarında protein agregasyonunun engellenmesine yardımcı olan “heat schock” proteinlerdir 22. Kalretikulin ve kalneksin adı verilen iki şaperon yapılarında kalan tek bir glikoza sahip mannozca zengin oligosakkaritleri tanıyarak katlanmamış glikoproteine bağlanır. Bu iki şaperon, lektinler gibi karbonhidrat bağlayıcı proteinler sınıfındadır. Spesifik karbonhidrat yapıları için bir tanınma ve bağlanma bölgelerine sahiptirler 11, 18.
Birçok hücre bileşeninin hidrolizini ve dönüşümünü gerçekleştiren lizozomlar, proteazlar, lipazlar, glikozidazlar gibi birçok lizozomal enzimler içerirler. Bu enzimler N-bağlı glikoprotein yapısındadır. Mannozca zengin oligosakkaritler bazı proteinleri hücredeki spesifik bölgelere hedefler 13. Golgideki Man 6-P reseptörü enzimi tanır, bağlar ve lizozomlara yönlendirir. Man-6P reseptörü hücre yüzeyinde de vardır. Bu sinyali içeren ekstraselüler enzimler de endositozla alınır ve lizozomlara transfer edilir 17.
Glikoproteinlerin oligosakkarit zincirleri proteinlerin çözünürlüğünü ve stabilitesini arttırır. Hücre dışına salgılanan pek çok protein (plazma proteinleri, maya ve mantarlardan salgılanan parçalayıcı enzimler) glikoprotein yapısındadır. N-bağlı glikoproteinler hayvan hücrelerinin yüzeyinde bulunur ve hücre-hücre etkileşimlerinde önemli rol oynarlar 15.
Glikoproteinlerin Fertilizasyondaki Önemi
Oositi saran zona pellusida (ZP) ZP-1, ZP-2 ve ZP-3 olmak üzere 3 glikoprotein içerir. Bunlardan en önemlisi sperm için bir reseptör olarak görev yapan ve O-bağlı glikoprotein olan ZP3'dür. Sperm yüzeyinde yer alan ve galaktozil transferaz olan bir protein ZP'nın oligosakkarit zincirleriyle etkileşir; proteazlar, hiyaluronidazlar ve sperm akrozomundaki diğer maddeler ortama salınır ve bu enzimler spermin ZP'yi aşmasına ve oositin plazma zarına ulaşmasına yardım ederler. Yine hamsterlerde bulunan bir glikoprotein olan PH-30'un sperm ve oosit plazma membranlarının birbirine bağlanmasında ve kaynaşmasında önem taşıdığı bilinmektedir. Bu glikoproteinlerin işlevlerini durduracak ilaç veya antikorlar geliştirilebirse döllenme engelleneceğinden bunların kontraseptif ajanlar olarak kullanılabilmesi mümkün olacaktır 11, 23.
Glikoproteinlerin İnflamasyondaki Rolü
Akyuvarların ve endotel hücrelerin yüzeyinde bunların hücreler arası adhezyona uğramasına katılan ve selektinler adı verilen özgül lektinlerin bulunduğu bilinmektedir. Vasküler endotel hücreleri hasara uğrarsa, inflamatuvar yanıt oluşur ve hasarlı dokudan sitokinler salınır, bunlar da akyuvarları çekerler. Bu etkileşim sonucunda lökositler damar duvarına yapışırlar.
Akyuvarların damar duvarına yapışması enfeksiyonla mücadelede son derece önemlidir 14, 24.
Yapısal Molekül Olarak Glikoproteinler
Glikoproteinlerin hücre membranlarının önemli ve aktif komponentleri olduğu bilinmektedir. Hücre membranlarının glikoproteinleri iki lipid tabakası arasına yerleşmiştir. Glikoprotein molekülü membranın bir ya da her iki yüzeyi ile temas edebilmesine karşın karbonhidratlar hemen hemen yalnızca dış yüzeyde bulunurlar 10. Yaşamın temel birimi olan hücreler dokulara yerleşmiş olup çoğunlukla bağ dokusu adı verilen bir hücre dışı yatakla çevrelenmişlerdir. Hücre dışı yatak üç büyük biyomolekül sınıfı içerir: Bunlar; yapısal proteinler (kollajen, elastin, fibrillin) özgülleşmiş proteinler (fibronektin, laminin), proteoglikanlar (kondroitin sülfat, keratan sülfat, dermatan sülfat, heparin) dır.
Kayganlaştırıcı ve Koruyucu Ajanlar: Müsinler; glikoprotein ve proteoglikanlardan oluşan sümüksel madde olup, mukusun büyük bir makromoleküler komponentidir 25. Solunum yolunda hücrelerin yüzeyini sıvar, girip çıkan ve ısısı ve rutubeti sürekli değişen havanın kurutucu etkilerinden hücreyi korur. Sindirim sistemindeki görevi ise yüzeyi kayganlaştırmak ve örtü epitel hücrelerini enzimlerin eritici etkilerinden korumaktır. Genital kanaldaki mukus içeriğinin kayganlığı sağlama dışında bakteriolitik etkisi de vardır. Zara bağlı müsinler çeşitli hücre-hücre etkileşimlerine katılır. Müsinler bazı yüzey antijenlerini maskeleme eğilimi de gösterirler 4.
Plazma Proteinleri: Plazma proteinlerinin hemen hepsi glikoprotein yapısındadır. Buna göre bu proteinler N ya da O-bağlı oligosakkarit zincirleri ya da her ikisini içerirler. Albüminde ise şeker kalıntıları bulunmaz.
İmmunoglobulinler
Antikor olarak fonksiyon gören bu proteinler de glikoprotein yapısındadırlar. Temel immunglobulin molekülü bir çifti ağır zincir (H) ve diğer bir çifti ise hafif zincir(L) olmak üzere 4 polipeptid zincirinden kurulur. Antijen bağlama bölgesi komşu ağır ve hafif zincirler arasındadır. Zincirler disülfit bağları ile birleşmiştir. İmmunglobulinler üç büyük (IgA, IgG ve IgM) ve iki küçük (IgD ve IgE) sınıfa ayrılır 3.
Kan Grubu Maddeleri
İnsan eritrosit membranları antijenik maddeler içerir. Bunlardan 300'den fazlası yaklaşık 18 kan grubu içinde sınıflandırılır. ABO, Lewis, Duffy, Kell, Kidd, Lutheran sistemleri bunlardan bazılarıdır. Bu sistemler glikoproteinler, glikolipidler ya da proteoglikanlar şeklinde bağlanmış oligosakkaritler olarak bilinirler. Sözü edilen antijen moleküllerinin %80-90'ı karbonhidrattır ve kan grubunun tipi redükte olmayan terminale yakın şeker kalıntıları aracılığıyla belirlenir 10.
Hormonlar
Birçok hormon glikoprotein yapısında olup bunlar; Lüteinleştirici Hormon (LH), Folikül Stimüle Edici Hormon (FSH), İnsan Koryonik Gonadotropini (HCG), Gebe Kısrak Serum Gonadotropini (PMSG), Balık Gonadotropik Faktör (FGF), Tiroid Stimüle Edici Hormon (TSH), Eritropoietin'dir 3.
Enzimler
Birçok enzim glikoprotein yapısında olup bunlardan bazıları; oksidoredüktazlar (glioksidazlar, seruloplazma peroksidaz, kloroper-oksidaz), transferazlar (α-glutamil transpeptidaz, ribonükleaz), hidrolazlar (lipaz, kolinesteraz, atropinesteraz, α galaktozidaz, alkalen fosfataz, deoksi ribonükleaz, amilaz, β fruktofuranosidaz, N-asetil β glukozaminidaz, β glukuronidaz, hyaluronidaz, oksitosinaz, kallikrein, bromelain, enterokinaz ) ve pepsinojendir 3.
Tümör Belirleyicileri
Tümör belirleyicileri, Tümör hücreleri ve embriyoner hücreler tarafından sentezlenen ve çeşitli vücut sıvılarında kalitatif ve kantitatif yöntemlerle tayin edilen maddeler olup genellikle glikoprotein yapısındadırlar. Tümör belirleyicileri günümüzde diğer teşhis yöntemleriyle birlikte kanser tanısında, tedaviye cevabın değerlendirilmesinde ve nüks eden hastalığın işareti olarak kullanılabilmektedir. Bu amaçla çok sayıda tümör belirleyicilerinden yararlanılmaktadır 26. Tümör belirleyiciler arasında en çok ilgi çekeni karsinoembriyonik antijen (CEA) olup 180 kDA molekül ağırlığında bir glikoproteindir 27.
Glikoproteinlerin Antijenik Özellikleri
Protein ve glikoproteinler hücre içi iletişimi sağlamada etkili elemanlardır. Proteinlerin bir çok kompleks oligosakkarit yapılarla dekore edilmiş olmasının nedeni uzun süre anlaşılamamış ancak son yirmi yılda glikobiyoloji alanındaki gelişmeler glikolizasyonun rolünün kısmi olarak anlaşılmasını sağlamıştır. Protein glikozilasyonu proteinlerin en yaygın posttranslasyonel modifikasyonudur ve proteinin antijenik özelliklerine katkıda bulunur. Bağışıklık sisteminde yer alan çoğu molekül de (hücre reseptörleri, sitokinler, antikorlar) glikozile Şekilde bulunurlar. Glikozilasyona uğramış proteinler farklı tip antijenik epitoplar taşırlar 7, 28) ve glikoproteinler immun sistem efektörlerinin anahtar bileşenleridirler 29, 30. Ayrıca glikoproteinlerin detaylı analizleri konak-mikroorganizma ve konak-parazit arasındaki ilişkilerin aydınlatılmasına böylece immun cevabın araştırılmasındaki eksik bilgilerin tamamlanmasına yardımcı olurlar.
Kanser Tanısında Glikoproteinler
Kanser tanısında glikoproteinlerin ayrı bir önemi vardır. Kanser tedavisinin başarılı olmasında temel ilke olabildiğince erken tanıdır. Günümüzde bazı istisnaları dışında en yaygın kullanılan ve üzerinde yoğun çalışmalar sürdürülen yöntemler immunolojik ve biyokimyasal yöntemlerdir. Malign hücrelerin kaybettikleri matür hücre özelliklerinin ve kazandıkları yeni özelliklerin pek çoğunun hücre membranındaki çeşitli değişikliklere bağlı olduğu gerçeği, tümör belirteci çalışmalarını plazma membran komponentlerine, dolayısıyla glikoprotein ve glikolipidlere yöneltmiştir. 25 Pek çok malignitede hücre yüzeyi, tümör dokusu ve serumdaki glikoprotein fraksiyonlarında değişiklikler bildirilmiştir 4, 9, 12, 30.
Glikoprotein ve glikolipid fonksiyonlarında belirleyici ve yardımcı rol oynayan oligosakkarit yan zincirlerinde yer alan çeşitli monosakkaritler araştırılmış, özellikle zincir sonlarında yer alan 2 şekerin; fukoz ve sialik asit'in pek çok malignitede serumda artmış olduğu tespit edilmiştir 31, 32.
Tedavi Edici Glikoproteinler
Günümüzde tedavi edici glikoproteinler biyoteknoloji ürünlerinin en önemli sınıfını oluşturur. Bunlar; eritropoietin, granülosit makrofaj koloni stimüle edici faktör ve doku plazminojen aktivatörüdür. İlave olarak halihazırda 60 rekombinant glikoprotein terapotik ajan olarak geliştirilmiştir. Bu glikoproteinler hücre kültürü sistemlerinde ya da transgenik hayvanlarda rekombinant ürünler gibi üretilmektedirler. Günümüzdeki en önemli biyoteknolojik ürünlerden biri eritropoietindir. Eritropoietin eritrosit progenitörlerinin çoğalmasını ve farklılaşmasını teşvik eder. Eritropoietinin kemoterapiden sonraki kemik iliği baskılanmasının tedavisinde önemli değeri vardır 12.
Tümörlü hastaların tedavisinde lektinlerin kullanılabileceğine ilişkin birçok araştırma yapılmıştır. Örneğin galaktoza spesifik bir lektin olan Viscum album aglutinin bugün tüm Avrupa'da tümörlü hastalarda geniş bir kullanım alanı bulmaktadır. Bütün tümör hücrelerine karşı 1-2 ng/kg vücut ağırlığı hesabına göre subkutan olarak verilen bu lektinin interleukin 1 ve interleukin2 gibi sitokinlerle, tümör nekroz faktörünün monositlerde üretimini arttırarak immun sistemi uyardığı rapor edilmiştir 19. Mistletoe lektin de denilen bu lektin ökse otundan elde edilen 63 kDa ağırlığında bir glikoproteindir. Bu lektinin anti-karsinojenik etkisiyle ilgili pek çok çalışma yapılmış olup 33-36 Choi ve ark. (2004) bu lektinin sadece tümörlü dokuları öldürdüğünü, sağlıklı dokulara zarar vermediğini rapor etmişlerdir 37. Bock ve ark. (2004) yapmış oldukları çalışmada meme kanserli hastalara Mistletoe Ekstraktını deri altı yolla vermişler, bu hastalar ekstraktı almayan kontrol grubu hastalara göre hastalık semptomlarını daha az gösterirken, hayatta kalma süreleri de uzamıştır 38. Aynı lektinin hücre yüzeyi epitoplarına bağlanarak hücre içi kalsiyum seviyesini arttırdığı ve belli proteinlerin fosfatlanmasını indüklediği bildirilmiştir 19. Mistleteo lektinin apoptozisi indüklediğini bildiren çalışmalar da vardır 35, 37. Thies ve arkadaşları (2008) farelere verilen düşük doz Mistletoe lektinin melanom büyümesini yavaşlattığını bildirmişlerdir 39 Potansiyel anti-karsinojen olduğu düşünülen diğer bir lektin ise soya fasulyesi lektinidir 40.
Lektinlerin kanser tedavisinde kullanılmasına yönelik geliştirilen bir görüş ise; anti kanser etkili ilaçların tümörlü dokularda yoğunluğunun ve etki zamanının arttırılması yönündedir. Bugün kullanılmakta olan kemoterapik ilaçların normal vücut hücreleri üzerine oldukça fazla yan etkileri bulunmaktadır. Hücreler için toksik olan ilaçlar, tümörlü dokular için spesifik olan bir karbonhidrat ünitesi ile bağlandıktan sonra vücuda verildiğinde toksik maddenin tümör hücresine lokalize olması ve bunun normal somatik hücrelerdeki etkisi minimuma indirilmesi beklenmektedir 19.
Glikoproteinlerin ve Glikozilasyonun Önemi ve Hastalıklardaki Rolü
Glikozilasyon sonucu proteinlere eklenen glikanlar immünolojik cevabın modifikasyonu, proteinlerin tanınması, hedeflenmesi ve proteinlerin katlanması gibi önemli rollere sahiptirler. Glikozilasyon mekanizmasındaki değişiklikler, glikozilasyonda kullanılan substrat moleküller ve oluşan ürünlerde yapı, fonksiyon ve miktar açısından meydana gelen değişiklikler çeşitli hastalıkların oluşum ve gelişimlerinde etkili olabilmektedir. Kompleks karbonhidrat zincirlerine ait yapısal anormalliklerin araştırılması insan hastalıklarının etiyolojisini ve patogenezinin anlaşılması için yeni ve önemli bir bakış açısı kazandırabilir 41.
Enfeksiyonlar çoğunlukla bakteri, virüs yada parazitlerin salgıladığı Lektin benzeri moleküllerin konakçı hücrenin yüzeyinde bulunan oligosakkaritlerle bağ yapması ile başlar 42.
Glikoproteinlerin O-ve N-glikan zincirleri ile glikoprotein düzeyi tümör hücrelerinde değişiklik gösterir. Tümörlü dokuda genelde O-glikanlar uçları kesik ve siyalilatlı iken N-glikanlar kanserde dallanmış ve siyalilatlıdırlar. Glikanların kanserdeki işlevsel önemi hakkındaki bilgilerimiz hala yeterli değildir. Bununla birlikte glikoproteinler kanser hücrelerinin yapısal niteliği tanı ve immunoterapi için yararlı olabilir 43.
Yapılan çalışmalarda; birçok kanser türü glikoprotein sentezinin artmasına yol açmaktadır. Özellikle sialik asit değerlerinin kanserli olgularda yüksek olması, diğer klinik ve biokimyasal kriterlerle birlikte serum sialik asit ölçümleri tanı koyma, hastalığı evrelendirme ve tedavide değerli bir laboratuar kriteri haline getirmektedir 44, 45.
Shamberger (1986) kanserli hastalarda yapmış olduğu çalışmada yüksek sialik asit değerleri saptamıştır. Kanserli hastalar üzerinde yapılan çalışmada sialik asit düzeylerinin belirli bir kanser tipine özgü olmaksızın yükseldiği gösterilmiştir ve serum sialik asit değerleri ile akut faz proteinleri arasındaki ilişki saptanmıştır 44. Ye ve ark. 46 tarafından karaciğer kanserli hastalarda yaptıkları çalışmalarda serum SE-selektin düzeyinin yükseldiği ve bunun hastalığın teşhisinde kullanım alanı bulabileceğini bildirmişlerdir. Takahaski ve ark. (1995) 52 kolon kanserli hasta üzerinde yaptıkları çalışmalarda SE-selektin düzeylerinin sağlıklı bireylerden yüksek olduğunu bildirmişlerdir 47.
Serum sialik asit seviyelerinin inflamasyon ile seyreden daha pek çok hastalıkta yüksek bulunmuştur; Bunlar, Behçet hastalığı, merkezi sinir sitemi hastalığı, kardiyovasküler rahatsızlıklar, bakteriyel enfeksiyonlar, psoriazis ve romatoid artrit'tir.
Romatoid artritte glikozilasyonda değişiklik söz konusudur ve bu değişikliğin derecesi hastalığın ciddiyetiyle doğru orantılıdır. Sağlıklı kişilerde serum IgG'nin oligosakkarit düzeni sabit kalırken romatoid artriti olan hastalarda dolaşımdaki IgG moleküllerinin N-glikan zincirlerinde görülen galaktozilasyon daha azdır. Bu nedenle de bu hastalar IgG moleküllerinin N-glikan zincirleri sonlarında Galaktoz (Gal) taşımazlar. Agalaktozil IgG olarak adlandırılan bu moleküllerin varlığı romatoid artrit için ayırt edici bir özelliktir ve hastalığın tanısında ve derecesinin belirlenmesinde kullanılan bir parametredir 48.
İnsan plazmasında sialik asidin büyük miktarı orosomukoid, alfa-1 antitripsin, haptoglobin serüloplazmin, fibrinojen, kompleman proteinleri ve transferrinde bulunur. Bu sialize glikoproteinlerin bazıları akut faz-reaktanları olarak adlandırılırlar ve inflamatuvar reaksiyon veya yaralanmanın başlangıcından itibaren konsantrasyonları hızlı artar 49.
Uysal ve arkadaşları (1997) yaptıkları çalışmada Tüberoskleroz'lu hastaların fibroblastlarından köken alan bir glikoprotein olan fibronektinin yüksek performanslı anyon değişim kromatografisi (HPAEC) ile analizinde proteindeki karbonhidrat kompozisyonunun kontrole göre 2-3 misli arttığını göstermişlerdir 50. Ayrıca, Uysal ve Hemming (1999) tarafından yapılan diğer bir çalışmada ise Tüberoskleroz'lu hastaların deri lezyonlarından köken alan fibroblastlar tarafından sentezlenen fibronektin, laminin, ve tenasin'in oranları belirgin bir Şekilde normal fibroblastlardan farklı bulunmuştur. Özellikle de tırnak fibromasından köken alan fibroblastların tenasin ve fibronektin glikoproteinlerinin çoğunluğunu sentezledikleri ve glikoproteinlerin hücre içerisinde (nükleus çevresi ile hücre yüzeyinde) yoğunlaştıkları bildirilmiştir 51.
Lipid bağlı sialik asit (LASA yada LSA) serum düzeylerinin, lösemi (kan kanseri), Hodgkin Hastalığı, cilt kanseri, sarkoma ve ovaryum kanseri gibi hastalıklarda önemli bir işaret olabileceği bildirilmektedir 52.
Veteriner hekimliği alanında, tümörlü köpeklerde α1-asit glikoprotein ve toplam sialik asit oranları arasında bir ilişkinin varlığı tespit edilmiştir. Meme tümörlü köpeklerin serumlarında sağlıklı olanlara göre toplam sialik asit düzeyleri yüksek bulunmuş, bu durumun da tümörlü köpeklerde alfa-asit glikoprotein sializasyonundaki artışa bağlı olarak oluşabileceği üzerinde durulmuştur 53. Kortizol ile sialik asit oranları arasındaki karşılıklı ilişkinin araştırıldığı diğer bir çalışmada immunosupresyon (savunma sisteminin baskılanması) oluşturulan genç buzağılarada serum sialik asit oranı çok yüksek bulunmuştur 54.
Tümörlü sığırlarda ve bufalolarda sialik asit ve lipid bağlı sialik asitin belirgin bir Şekilde yükseldiği görülmüş bunun ise anormal hücre çoğalmasına bağlı olarak hücre yüzeyindeki glikoprotein ve glikolipidlerin artışından kaynaklanabileceği ileri sürülmüştür 55.
Bir köpek türü olan Iscadorlar üzerine yapılan çalışmada, metastatik tümör büyümesi olan ve uyarılan NK hücreleri (doğal öldürücü) ile tedavi gören hayvanlarla, görmeyenler karşılaştırılmış ve sonuçta metastazın azaldığı ve bu durumun kalın bağırsaktaki hidroksi prolin içeriğindeki serum sialik asit oranlarının düşmesine bağlı olabileceği bildirilmiştir 56.
Sonuç olarak, canlı vücudunda bulunan farklı işlevlere sahip birçok protein glikoprotein yapısındadır. Glikozilasyon, proteinlerin sentezlendikten sonra meydana gelen posttranslasyonel modifikasyonudur. Glikozilasyon endoplazmik retikulumda protein sentezi sırasında veya protein sentezlendikten sonra Golgi aygıtına transferi sırasında meydana gelir. Glikoproteinlerin karbonhidrat zincirlerinin fonksiyonu çeşitlidir; Proteini proteolitik parçalanmaya karşı korur ve denaturasyona karşı stabilize edebilirler, çözünürlüğü arttırırlar veya hücreler arası etkileşimlerde hücrelerin birbirini tanımasını sağlarlar. Glikoproteinlerin, antijenik özelliklerinin yanında, fertilizasyon ile inflamasyonda, kayganlaştırıcı ve koruyucu ajanlar ve yapısal moleküller olarak önemli görevleri vardır. Glikoproteinler konusunda yapılacak yeni çalışmalarla, yeni tedavi edici rekombinant glikoproteinler geliştirilebilecektir. Günümüzün en yaygın hastalıklarından biri olan kanserin tanı ve tedavisindeki öneminden dolayı glikoproteinler üzerinde daha geniş kapsamlı çalışmalara ihtiyaç vardır.
Glikobiyoloji de önemli bir yeri olan glikoproteinler, veteriner hekimliğinden ziyade özellikle beşeri hekimlikte geniş bir çalışma ve uygulama alanı bulmuştur. Sonuç olarak hayvan hastalıklarının moleküler mekanizmasının anlaşılabilmesi ve hastalıkların teşhis ve tedavisinde glikoproteinlerin kullanılabilirliğinin tespiti açısından veteriner hekimliği alanında glikoproteinlerle ilgili daha fazla sayıda araştırmaya ihtiyaç duyulduğu kanaatine varılmıştır.