Deneysel uygulamalar, Fırat Üniversitesi Hayvan Deneyleri Etik Kurulu'ndan onay alınarak gerçekleştirildi (Karar no: 02.05.2008/17).
Deney Hayvanları: Deneysel çalışmalarda, canlı ağırlıkları ortalama olarak 192 g (192 ± 30 g) olan toplam 36 adet iki aylık Wistar albino cinsi erkek sıçan kullanıldı. Bu sıçanlar adaptasyon amacıyla bir hafta boyunca standart fare yemi ile beslendi ve su alımı serbest bırakıldı. Daha sonra sıçanlar altı gruba ayrıldı. Bu gruplar ve gruplara verilen madde konsantrasyonları aşağıda belirtilmiştir:
1. Kontrol grubu
2. H2O2 (Hidrojen Peroksit)+ FR (Fenton Reaktifi) grubu
3. Kayısı grubu
4. Üzüm grubu
5. FR+H2O2+Kayısı grubu
6. FR+H2O2+Üzüm grubu
Kontrol grubuna dimetil sülfoksid (DMSO) verildi. Radikal grubuna 100 ml distile su için 100 µl H2O2 ve 0.1 g FR karıştırılıp 500 µl gün aşırı olmak üzere sıçanlara intraperitonal yolla enjekte edildi. Meyveler ise 50/250 oranında %85' lik metanol ile ekstrakte edildi. Kullanılmaya hazır hale getirilen ekstraktlar gruplara 500 µl gün aşırı olmak üzere intraperitonal yolla enjekte edilip, uygulama 60 günlük süre sonunda tamamlandı. Bu sürenin sonunda bir gece öncesinden yemleri alınan sıçanların 12 saatlik açlık periyodundan sonra kan örnekleri eter anestezisini takiben median laparotomi sonrasında kalpten punksiyon ile EDTA'lı tüplere alındı ve analize kadar -20ºC'de bekletildi.
İnceleme Materyali: Çalışmada kullanılan meyve örnekleri Malatya ilinden mevsimsel dönemlerinde 2008 yaz aylarında toplandı. Kayısı türlerinden Hacıhaliloğlu Darende ilçesinden tüketilme olgunluğuna eriştiğinde ağaçlardan toplandı. Üzüm türlerinden Banazı Karası ise; Banazı kasabasından temin edildi. Çalışmada kullanılan meyve örnekleri steril poşetler içine konularak analiz yapılıncaya kadar -60ºC'de tutuldu.
Bitki Ekstraktlarının Hazırlanması: Kayısı (Prunus armeniaca) ve üzüm (Vitis vinifera) için 50/250 oranında metanol ekstraktı hazırlandı. Ekstraktlar blenderda örnek bitki grubunun çözücüler içerisinde parçalanmasıyla elde edildi. Blenderde parçalama işleminden sonra örnekler santrifüj edildi (5000 rpm +4°C). Santrifüj sonunda elde edilen supernatantdan rotovapor kullanılarak çözücüler ortamdan uzaklaştırıldı. Kullanılmaya hazır hale getirilen ekstraktlar -60ºC' de donduruldu.
Resveratrol ve Flavonoid İçeriğinin Belirlenmesi: Flavonoidlerin kromatografik analizi için 5 µm iç çapında PREVAIL C18 (15x4.6 mm) ters-faz kolon kullanıldı. Mobil faz olarak %1 asetik asit içeren metanol/su/asetonitril (46/46/8, v/v/v) karışımı kullanıldı15. Kateşin ve naringin için 280 nm, rutin, mirisetin ve morin için 254 nm, resveratrol için 306 nm dalga boyu kullanılarak RHPLC (Radyo Yüksek Performanslı Sıvı Kromatografi) ayrımını takiben DAD (Diode-Array Dedektör) tarafından bu flavonoidlerin ölçümü yapıldı. Akış hızı 1.0 ml/min ve enjeksiyon değeri 10 µL olarak ayarlandı. Analizlerin kromatogafik pikleri reaksiyon sürelerinin karşılaştırılması ve standart referanslarının UV spektrumları ile doğrulandı. Miktar ölçümü standart metot kullanımıyla pikin birleştirme yoluyla gerçekleştirildi. Tüm kromatogafik işlemler 25°C'de yapıldı.
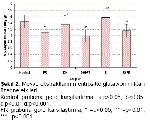
Lipid peroksidasyon Miktarının Ölçülmesi: EDTA'lı tüplere alınan kan örnekleri +4ºC'de 5000 rpm'de 10 dakika süre ile santrifüj edilip, serum ile eritrosit kısmı ayrıldı. Eritrosit örneklerinin LPO düzeyinin ölçümü Ohkawa ve ark.'nın metodunda bazı modifikasyonlar yapılarak HPLC cihazında floresan dedektör ile ölçüldü16. Bunun için eritrosit pelletlerinden 1g tartıldı ve 2ml olarak serum fizyolojik ilavesinden sonra santrifüj edildi. Elde edilen süpernatantdan 500 µl alındı, 0.084 N H2SO4 ‘den 6 ml ve %10'luk PHA'dan 3ml olarak ilave edildikten sonra
oda sıcaklığında 5 dakika bekletilip 5000 rpm'de 10
dakika santrifüj edilerek üst sıvı atıldı. Kalan pellet üzerine 1ml distile su ilave edilip çözündükten sonra 1 ml % 3'lük hidroklorik asit ve 1ml % 0.6'lık TBA eklendi ve 95ºC'de 60 dakika bekletildi. Bu süre sonunda soğuyan örneklere 3 ml butanol ilave edilip, santrifüj edildikten sonra süpernatantdan 1ml viallere alınarak ölçüm HPLC cihazında floresan dedektör ile gerçekleştirildi.
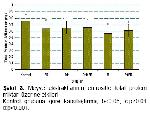
Glutatyon Miktarının Ölçülmesi: Eritrosit pelletlerinin yaş ağırlığı belirlendi. Önce beş ml Tris-EDTA tamponu ile yıkandı. Yıkama sonunda elde edilen süpernatant alınıp, glutatyon miktarı Elman reaktifi kullanılarak 412 nm'de spektrofotometrik olarak belirlendi17. Eritrosit pelletlerindeki glutatyon miktarının hesaplanmasında mg/g hücre pelleti miktarı cinsinden belirlendi.
Total Protein Miktarının Ölçülmesi: Örneklerin total protein miktarlarının ölçümü Lowry yöntemine göre yapılıp, sonrada 750 nm'de balnk'a karşı spekrofotometrede okundu18.
İstatistik Analizi: İstatistiksel analiz için, SPSS 15.0 software programı kullanıldı. Kontrol grubu ile deneysel grupları arasındaki karşılaştırma varyans analizi (ANOVA) ve LSD (En küçük anlamlı fark analizi) testleri kullanılarak yapıldı. Sonuçlar mean±SEM olarak verildi. Anlamlılık düzeyi olarak p<0.05 kabul edildi.