Kuru göz sendromu; insanlarda kadın ve yaşlılar; hayvanlarda ise köpeklerde yaygın olarak görülen multifaktöriyel bir göz hastalığıdır. Gelişiminde yaş, cinsiyet, çevre, hormon ve beslenme gibi birçok etiyolojik faktörün etkili olduğu bildirilmiştir. Hastalığın patogenezisinde inflamasyonun önemli bir rol oynadığı, dolayısıyla tedavisinde antiinflamatuar ajanların öne çıktığı görülmektedir. Son dönemlerde hastalığın semptomatik tedavisinden ziyade patogenezisinde rol oynayan faktörlerin hedef alındığı görülmektedir. Bu derlemede KGS güncel bilgiler ışığında değerlendirilmiş ve mevcut tedavi metodları detaylı bir şekilde anlatılmıştır.
Tanım
KGS; oküler yüzeye hasar verme potansiyeline sahip yangı, gözyaşı film hiperosmolaritesi, instabilitesi ve görme bozukluğu ile karakterize multifaktöriyel bir hastalık olarak tanımlanmıştır1.
İnsidens
KGS'nin köpeklerde2,3 yaygın, Amerikan Cocker Spaniel, Minyatür Schnauzer, Poodle, ShihTzu, Lhasa Apso, Pug, İngiliz Buldog2 ve West Highland White3 gibi ırklarda ise kalıtsal olduğu rapor edilmiştir. Hastalığın, diğer evcil hayvanlarda yaygın olmadığı, bu durumun yeterli insidens çalışmasının yapılmamasına bağlı olduğu sanılmaktadır4. Hastalık kanatlı ve sürüngenlerde de rapor edilmiştir5. KGS'nin her yaş ve cinsiyette insanlarda görüldüğü ancak prevalansının kadın ve yaşlılarda daha yüksek olduğu belirtilmektedir6,7. Kadınlarda özellikle postmenapozal dönemde olanlarda daha sık görüldüğü, bunun androjen ve östrojen seviyelerindeki azalmayla ilişkili olabileceği sanılmaktadır6,8. Hastalığın yaşlı bireylerde yaygın olmasının niktitans ve lakrimal bezlerin fonksiyonel kapasitelerinde meydana gelen azalmaya bağlı olduğu belirtilmiştir7.
Etiyoloji
KGS'nin etiyolojisinde; yaş, cinsiyet, çevre, hormon, beslenme, sistemik ve lokal etkili ilaçlar gibi bir çok faktörün (Şekil 1) etkili olduğu bildirilmiştir6,7,9,10. Düşük relatif nem ve yüksek ortam sıcaklığı gibi evaporatif stres faktörlerinin ise prekorneal gözyaşı filmi üzerine negatif etki yaparak KGS'yi tetiklediği öne sürülmektedir9,11. Ayrıca tozlu, rüzgarlı ve güneşe maruz kalma süresi uzun olan tropikal iklim bölgelerindeki bireylerin KGS'ye eğilimli oldukları vurgulanmıştır12.
Gıdalarda bulunan omega-3 ile omega-6 oranları, vücuttaki anti-inflamatuar aktiviteleri primer olarak etkilemektedir13. Bu iki esansiyel yağ asidi arasındaki dengenin omega-6 lehine aşırı kaymasının yangı öncesi prostaglandin-E2 (PGE2) seviyesini arttırıp, prostaglandin-E1 (PGE1) ile prostaglandin-E3 (PGE3) gibi anti-inflamatuar ajan seviyelerini ise düşürerek KGS'ye neden olabileceği öne sürülmüştür14. Öte yandan vitamin-A eksikliğinin lakrimal bezde hasar oluşturup goblet hücrelerinin gelişimini bozarak KGS'ye neden olabileceği vurgulanmıştır10.
Östrojen ve androjen gibi seks hormonlarının, meibomian bezlerinden lipid, lakrimal bezlerden ise aköz üretimini arttırarak normal gözyaşı fonksiyonu ve oküler yüzey epitelyumu üzerine faydalı etkiler gösterdiği belirtilmektedir6. Yaşlanma ve anti-androjenik ilaç kullanımı gibi etkilerin androjenlerin sentezinde azalmaya yol açarak evaporatif KGS ve meibomian bez disfonksiyonuna sebebiyet verebileceği bildirilmiştir15.
Yaşın ilerlemesiyle ortaya çıkan birçok sistemik hastalığın tedavisinde kullanılan antikolinerjik, diüretik ve antihistaminikler gözyaşı üretimini baskılayarak KGS'ye neden olabilmekte veya varolan hastalığı kötüleştirebilmektedir6,10,15. Ayrıca prezervatif içeren yapay gözyaşı preparatları ile glakom tedavisinde kullanılan bazı ilaçların sık aralıklarla uygulanmalarının KGS'nin gelişimine katkıda bulunabileceği belirtilmektedir16.
Diabetes mellitus'un gözyaşı kırılma zamanı testi (GKZT), schirmer gözyaşı testi (SGT) ve goblet hücre dansitesinde önemli azalmalara ve prekorneal gözyaşı filmi (PGF)'nin instabilitesi ile birlikte konjunktivada belirgin bir squamos metaplaziye neden olduğu rapor edilmiştir17. Ayrıca otoimmun hastalıklar, radyasyon tedavisi ve kemik iliği transplantasyonu da KGS'nin diğer önemli etiyolojik faktörler arasında sayılmaktadır1.
Patogenezis
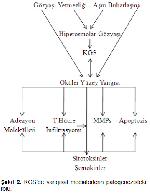
KGS'nin patogenezisinde; gözyaşının miktarı, döngüsü, akışı, osmolaritesi ile yangı anahtar rol oynamaktadır. Gözyaşının miktarı, döngüsü ve akışındaki azalma osmolariteyi arttırmakta, bu artış ise oküler yüzeydeki yangısal yolları aktive etmektedir. Oküler yüzey yangısının oluşumunda; evaporatif stres, hiperosmolarite, lakrimal bez tarafından salgılanan yangı öncesi sitokinlerin konsantrasyonlarındaki artış (Şekil 2) ve göz kırpma anormallikleri gibi faktörler rol oynamaktadır18,19. Yangı, lakrimal bezler ile oküler yüzey arasındaki sinirsel iletişimi bozarak, korneal duyarlılıkta, gözyaşı temizlenmesinde ve akışında azalmalara yol açmaktadır. Belirtilen siklusta yangının öneminin büyük olduğu ve hastalığın patogenezisinin temelini oluşturduğu vurgulanmıştır20-22.
Oküler yüzey ve glandular epitelyal hücrelerdeki stres ile PGF osmolaritesindeki artış, yangı öncesi sitokinler (IL-1β, IL-1α, IL-6, IL-8, TNF-α) ile bazı proteolitik enzimlerin gözyaşındaki seviyelerinde artışa sebebiyet verir23. Bu proteolitik enzimlerden biri olan matriksmetalloproteinazların (MMPs)24 korneal epitelyal hücreler arasındaki bağlantıyı sağlayan proteinleri ve bazal membranın komponentlerini lize ederek, epitelyal bariyeri bozduğu öne sürülmektedir24,25. Yapılan birçok çalışmada24,25 KGS'li hastaların gözyaşlarında ve korneal epitelyumlarında MMP-9 aktivitesinin yükseldiği bildirilmektedir.
KGS'nin patogenezisinde hiperosmolarite ve evaporatif stresin anahtar rol üstlendiği bilinmektedir26. Bu stres faktörleri, immun ve yangısal hücreleri indükleyerek inflamasyonu başlatır ve gelişiminde önemli rol oynayan şemokinleri aktive eder27. Ayrıca HLA-DR ve ICAM-1gibi immun aktivasyon ve adhezyon molekülleri oküler yüzeydeki yangısal sürecin başlamasında ve devamında etkilidir. Gözyaşı, konjunktiva ve lakrimal bezlerdeki yangısal mediatörler bu moleküllerin konsantrasyonlarını arttırmaktadır21,23.
Klinik belirtiler
KGS'nin başlangıç döneminde; gözlerde kuruluk, yabancı cisim ve batma hissi, kaşıntı, ağrı, yanma, fotofobi, görmede bulanıklık, kızarıklık, mükoz akıntı ile bazı hastaların gözlerinde aşırı yaşarma gibi semptomlar rapor edilmiştir28-30.
Hastalığın ilerlemesiyle; aşırı göz kırpma, fotofobi, ağrı, ağrıya bağlı bleferospazm ve enoftalmus, uzun süreli müköz gözyaşı akıntısı, göz çevresinde kabuklanma, blefaritis, hiperemi ve kaşıntı ile karakterize konjunktivitis, episkleral ödem ve kapillar damarlarında konjesyon, korneal ülserasyon, hücresel infiltrasyon, pigmentasyon ve neovaskülarizasyona bağlı olarak korneal yüzeyde kalınlaşma veya fibrozis, skar doku oluşumu, opasite ve körlüğe kadar varan değişiklikler görülmektedir31-35.
Teşhis
KGS, gözyaşı yetersizliği ve buharlaşması olmak üzere 2 ana kategoride sınıflandırılmaktadır (Şekil 1)21,36. Her iki kategorinin de klinik semptomlar, oküler yüzey hasarı, PGF instabilitesi ve hiperosmolaritesi açısından ortak özelliklere sahip olduğu belirtilmektedir21,36. Bu özelliklerin değerlendirilmesinde; oküler boyama, aköz gözyaşı üretim miktarı, gözyaşı kırılma zamanı, gözyaşı osmolaritesi, gözyaşı fluorescein temizlenme testleri ve goblet hücre dansitesi gibi diagnostik testlerden yararlanılmaktadır10,36-39.
Oküler Boyama Testleri: KGS'nin teşhisinde fluorescein sodyum, rose bengal ve lissamine green gibi oküler yüzey boyaları rutin olarak kullanılmaktadır37.
Fluorescein Sodyum: Suda çözünebilen turuncu renkli vital bir boyadır37,38. Slit-lamp biyomikroskopta mavi filtre altında fluoresan yeşili bir renkte görülmektedir. Gözde iyi tolere edilmekte ve minimal irritasyona neden olmaktadır36. Fluorescein sodyumun kullanıldığı boyama testi, oküler yüzey hasarının belirlenmesinde 19. yüzyıldan beri kullanılan standart bir tekniktir36. Oküler yüzeydeki boyama alanları kobalt mavisi ile sarı filtreye sahip bir slit-lamp biyomikroskop altında muayene edilmektedir38. Bu metod, başta KGS olmak üzere korneal epitelyal erozyonlarla seyreden tüm hastalıkların teşhisinde yaygın olarak kullanılmaktadır37.
Rose Bengal: Oküler yüzey hasarını, ölmüş veya dejenere olmuş hücreleri boyayarak göstermektedir36,37. Bu boyanın uygulanması esnasında hastaların oküler yüzeylerinde ağrı ve yanma oluşturabilmesi37, boyanan hücrelerde morfolojik değişiklikler, motilite kaybı, ayrılmalar ve ölümlere neden olabilen intrinsik bir toksisiteye sahip olması gibi bazı dezavantajları vardır37,38,40. Sadece ölmüş ve dejenere olmuş hücreleri değil aynı zamanda canlılığını koruyan epitelyal hücreleri de boyadığından KGS'nin teşhisinde yanıltıcı sonuçlar verebilmektedir41.
Lissamine Green: Rose bengal benzeri bir boyama karakteri gösteren, yeşil renkli, düşük toksisiteli bir boyadır. Oküler yüzeyi daha az irrite ettiği, fluorescein gibi iyi tolere edildiği ve yalnızca hasara uğramış hücreleri boyadığı belirtilmektedir37,38,42,43.
Gözyaşı Kırılma Zamanı Testleri: PGF stabilitesi, oküler yüzey sağlığında anahtar bir role sahiptir. Bu yapının yangı gibi çeşitli nedenlerle instabil hale gelmesiyle oküler bütünlük bozulmaktadır10. PGF stabilitesinin değerlendirilmesinde GKZT rutin olarak kullanılmaktadır36-38. Bu test, aköz gözyaşı yetersizliği veya gözyaşı kurumasından ileri gelen KGS'li ve meibomian bez disfonksiyonlu bireylerde diagnostik öneme sahiptir37. GKZT, göze fluorescein uygulanmasını takiben iki tam göz kırpma arasında oküler yüzeyde noktasal kurulukların ilk tespit edildiği zaman olarak bilinmektedir36-38. Kırılma alanları, slit-lamp biyomikroskop altında kobalt mavisi veya sarı filtre kullanılarak tespit edilir36. GKZT'nin normal bireylerde ortalama 27 saniye, KGS'li hastalarda ise ortalama 5 saniye olduğu bildirilmiştir37.
Gözyaşı Osmolaritesi Testleri: Gözyaşı osmolaritesi, son zamanlarda KGS'nin tüm formlarında oküler yüzey hasarının belirlenmesinde kullanılan önemli bir parametredir39. Normal bireylerde gözyaşı osmolaritesinin 300-310, hayvanlarda ise 400-600 mOsM/kg olduğu, KGS'li insanlarda ise bu değerlerin 316 ile 360 mOsM/kg arasında değiştiği rapor edilmiştir44. Tavşanlarda meibomian45 ve lakrimal bez kanallarının kapatılması46 ile yapılan kuru göz modellerinde deneklerin gözyaşı osmolaritelerinin yükseldiği tespit edilmiştir.
Gözyaşı Fluorescein Temizlenme Testleri: Oküler yüzeyin fonksiyonel ünitesinin en dinamik yapısı olan gözyaşı filmi; yüzeyin temizlenmesi, beslenmesi ve yağlanmasını sağlamakta, dış etkenlere karşı ise fiziksel ve immunolojik bir bariyer görevi yapmaktadır21,22. Bu yapının en önemli fonksiyonlarından biri olan gözyaşı temizlenmesi, oküler yüzey sağlığının korunmasında etkili bir rol oynar47. Sağlıklı bir gözde stabil olan PGF, oküler yüzeyi yabancı cisimlerden, toksik maddelerden ve yangısal sitokinlerden temizler48. Gözyaşı temizlenmesindeki yetersizlik; oküler yüzeydeki yangı, irritasyon, epitelyal hasar ve aköz gözyaşı üretim miktarındaki azalmayla ilişkilidir47-49. Bu yetersizlik, gözyaşında sitotoksik faktörlerin, proteolitik enzimlerin ve yangı öncesi sitokinlerin birikimine neden olarak yangıyı tetiklemektedir47.
Lakrimal fonksiyonel ünitenin ve PGF kalitesinin değerlendirilmesinde gözyaşı fluorescein temizlenme testlerinden yararlanılmaktadır38. Bu testlerin fluorescein temizlenme zamanı (FTZT)50,51, temizlenme oranı (FTOT)52 ile fluorofotometrik analiz gibi metodları vardır38.
Fluorescein Temizlenme Zamanı Testi: FTZT, oküler yüzeye fluorescein damlatıldıktan sonra gözyaşının bu boyayı temizlemesi için gerekli zaman olarak tanımlanmaktadır50,51. Bu test ile bazal ve refleks gözyaşı miktarlarıyla birlikte gözyaşı temizlenme zamanı da belirlenebilmektedir. FTZT'nin, pahalı olmaması, kolay uygulanabilmesi ve materyallerin rahatlıkla temin edilebilmesi gibi avantajları; istenilen spesifiteye ve duyarlılığa sahip olmaması gibi dezavantajları vardır37.
Fluorescein Temizlenme Oranı Testi: FTOT, teknik açıdan FTZT'ye benzerlik göstermektedir37. FTOT, olguların konjunktival forniksine fluorescein damlatıldıktan belli bir süre sonra SGT stripleriyle ıslaklık derecesinin ve boya yoğunluğunun ölçülmesi esasına dayanır52. Islaklık derecesinin düşük, boya yoğunluğunun ise yüksek olması; gözyaşı temizlenmesinin geç olduğunu işaret etmektedir53.
Fluorofotometrik Analiz Testi: Fluorofotometrik analiz, gözyaşı temizlenmesinin değerlendirilmesi amacıyla olguların gözlerine fluorescein damlatıldıktan sonra belli aralıklarla gözyaşı örneklerinin alınması ve bu örneklerin fluorofotometrik olarak ölçülmesinden oluşmaktadır48,54. Bu analiz üzerine detaylı araştırmanın Dursun ve ark49 tarafından yapıldığı görülmektedir.
Aköz Gözyaşı Üretim Miktarı Testleri: KGS'nin evaporatif ve aköz yetersizlik olarak sınıflandırılmasında, gözyaşı üretim miktarı temel teşkil etmektedir37,38. Hayvanlarda gözyaşı üretim miktarının belirlenmesinde schirmer gözyaşı (SGT) ve fenol kırmızısı pamuk ipliği (FKPT) testlerinden yararlanılmaktadır37.
Schirmer Gözyaşı Testi: SGT, insan ve hayvanlarda gözyaşı miktarının ölçümünde rutin olarak kullanılmaktadır38. Bu testte 35 mm uzunluğunda ve 5 mm genişliğinde absorbent şeritlerden yararlanılır37,38. Alt göz kapağının içinde bulunan lakrimal göl kurutulduktan sonra lateral kantusa yerleştirilen bu şeritler, 1-5 dakika sonra alınarak üzerindeki milimetrik skaladan ıslaklık miktarı okunmaktadır. Anestezi uygulanmadığında total (SGT-I), uygulandığında ise bazal gözyaşı sekrasyonu (SGT-II) ölçülmektedir38. Bu testin, klinik ve deneysel KGS olgularının değerlendirilmesinde faydalı olduğu ve ıslaklık derecesinin 6 mm/dk'dan az olmasının hastalığı işaret ettiği belirtilmiştir36. SGT'nin göz küresi büyük olan insan ile tavşan, maymun ve köpek gibi hayvanlarda uygulanmasının kolay, göz küresi küçük olan fare ve rat gibi laboratuar hayvanlarında ise zor olduğu rapor edilmiştir38.
Fenol Kırmızısı Pamuk İpliği Testi: FKPT, ilk olarak Hamano ve ark55 tarafından küçük laboratuar hayvanlarında aköz gözyaşı üretimini ölçmek amacıyla kullanılmıştır. SGT'de olduğu gibi alt göz kapağına hafif bir şekilde yerleştirilen bu iplikler, yaklaşık 15 saniye sonra olduğu yerden alınmakta ve sarı rengin kırmızıya dönüştüğü sınır testin uygulandığı gözün aköz gözyaşı miktarını vermektedir37.
FKPT'nin uygulama süresinin SGT'ye göre kısa olması, nem ve sıcaklık gibi faktörlerden daha az etkilenmesi, minimal invaziv ve refleks gözyaşı stimülasyonuna minimal derecede neden olması daha güvenilir olduğunu göstermektedir38,56. Bu teknik günümüzde deneysel çalışmalarda sıklıkla kullanılmaktadır49,57.
Goblet Hücre Dansitesi Testleri: Konjunktival goblet hücreleri tarafından üretilen müsinin oluşturduğu müsin tabaka, oküler yüzey sağlığının korunmasında oldukça önemli bir yere sahiptir58. KGS ve squamosus metaplazi gibi hastalıklarda goblet hücre dansitesindeki azalma, PGF'nin müsin tabakasına zarar vererek oküler yüzey bütünlüğünü bozmaktadır59.
Goblet hücrelerinin konjunktivadaki dağılımı genelde düzenli olmasına rağmen fare ve ratlarda fornikslerde kümeleşmeler halinde yoğunlaştıkları60,61 tespit edilmiştir. Goblet hücre dansitesi KGS çalışmalarında yaygın olarak değerlendirilmektedir59.
İmpresyon Sitolojisi Testi: İmpresyon sitolojisi; goblet hücre dansitesini, nükleus sitoplazma oranını ve epitel hücre morfolojisini belirlemek amacıyla oküler yüzey biyopsilerine alternatif olarak geliştirilen basit, ucuz, noninvazif bir tekniktir10,62. Bu teknikte, göz anestezikleri uygulandıktan sonra bulbar, inferior ve temporal konjunktiva gibi oküler yüzey epitelyumunun yüzeysel tabakalarından, 0.25 veya 0.45 µm por çapına sahip nitroselüloz veya polietersülfon gibi filtre kağıtları kullanılarak doku örnekleri alınmaktadır59. Yüzey epitelyumuna filtre kağıtlarının yaklaşık 2-3 saniye kadar hafif bir şekilde bastırılmasıyla alınan bu örnekler, Nelson ve ark62'nın tanımladıkları prosedürler takip edilerek periyodik asid + shiff (PAS) ve hematoksilen ile boyanarak değerlendirilir.
İmpresyon sitolojisi tekniği ile konjunktival epitelyumdan alınan örneklerin, goblet hücreleri gibi subapikal ve apikal hücreleri de içerdiği belirtilmektedir. Böylece hem goblet hücrelerinin dansitesi belirlenmekte hem de goblet ve konjunktivanın suprabazal hücrelerinde mevcut olan jel formundaki müsinlerin analizi yapılmaktadır63. İmpresyon sitolojisi tekniğinin kullanıldığı bir KGS tavşan modelinde, goblet hücre dansitesinin önemli ölçüde azaldığı rapor edilmiştir59. Benzer sonuçlar, Yüksel ve ark.64'larının klinik çalışmasında da alınmıştır. Bolzan ve ark.65, köpekler üzerinde yaptıkları konjunktival impresyon sitolojisi çalışmalarında bu tekniğin veteriner oftalmoloji alanında da kullanılabileceğini belirtmişlerdir.
Tedavi
KGS'nin semptomlarını içeren şikayetlerle gelen hasta sahiplerine, öncelikle hastalarının yaş7, cinsiyet, çevre, hormon, beslenme, sistemik ve lokal etkili ilaçlar gibi etiyolojik faktörlerden etkilenip etkilenmediği sorulmakta daha sonra bu faktörlerin önlenmesi yönünde bilgi verilmektedir6,7,9,10,14. Etiyolojik faktörlerin elemine edilmesi amacıyla alınan tüm önlemlere rağmen oküler şikayetleri devam eden hastalara medikal tedavi yöntemlerinin; bunlardan da sonuç alınamazsa operatif müdahalelerin yapılması gerektiği bildirilmiştir20. Hayvanlarda KGS'nin tedavisi insanlardaki gibi hastalığın şiddetine göre medikal veya operatif olarak yapılmaktadır3,7,33.
Medikal Tedavi: Medikal tedavi, geçmişte etiyolojik ve etiyopatolojik faktörlerden çok klinik belirtilere yönelik olarak yapılmaktaydı6. Yeni tedavi konseptinde ise hastalığın altında yatan nedenler ile patogenezisinde rol oynayan faktörlerin ortadan kaldırılması hedeflenmektedir6,20. Bu amaçla kortikosteroidler66, nonsteroid antiinflamatuar ilaçlar (NSAID)67, immunosupresif veya immunomodülatörler68, sistemik tetrasiklinler (69), seksüel hormonlar70, vitamin A71, otolog serum72 ve mast hücre stabilizatörlerinin73,74 kullanıldığı görülmektedir.
Nonsteroid Anti-inflamatuar İlaçlar: NSAID'ler, oküler yangının kontrol altına alınmasında sıklıkla kullanılmaktadır18. Bu ajanların, alerjik konjunktivitis semptomlarının hafifletilmesi, intra-operatif miyozisin önlenmesi, pre ve post-operatif oküler yangı ve katarakt cerrahisi ile ilişkili cystoid macular ödemin tedavisi ve refraktif cerrahi sonrasında şekillenebilecek ağrının azaltılması gibi birçok kullanım alanı vardır18.
Endojen prostaglandinler, oküler yangının başlamasında ve devamında önemli rol oynamaktadır. Prostaglandinlerin, intraoküler basıncı etkilediği, konjunktival hiperemi ve miyozisi oluşturduğu, kan-oküler bariyer permabilitesini arttırdığı, ağrı ve alerjik reaksiyonları içeren hücresel ve humoral yangı sürecine aracılık ettiği ve şemokinetik aktiviteye sahip olduğu öne sürülmüştür75. NSAID'lerin, siklooksijenaz enzimlerini bloke ederek endojen prostaglandin ve diğer maddelerin sentezini inhibe ettiği bildirilmiştir76.
NSAID'lerin steroid tedavisinden kaynaklanan potansiyel komplikasyonlardan sakınmak için özellikle KGS gibi kronik yangısal göz hastalıklarının tedavisinde kortikosteroidlere alternatif olarak kullanılması önerilmektedir76. Bu amaçla bromfenak, diklofenak, flurbiprofen, indometazin, ketorolak, nepafenak ve suprofen gibi ajanlar sıklıkla kullanılmaktadır75. Bir çalışmada KGS üzerine nepafenak, ketorolak, bromfenak ve diklofenak gibi lokal NSAID'lerin etkileri; gözyaşı üretim miktarı, korneal fluorescein boyanma ve göz kırpma sayısı testleri kullanılarak değerlendirilmiştir. Tedavinin 2. haftasında nepafenak uygulanan olgularda korneal fluorescein boyanma alanlarında belirgin azalmalar gözlenirken; ketorolak, diklofenak ve bromfenak uygulananlarda ise tedavinin üzerinden 4 hafta geçmesine rağmen boyama alanlarında kısmi bir azalmanın olduğu kaydedilmiştir76.
Yapay Gözyaşı Preparatları: Prezervatif ve non-prezervatif yapay gözyaşı ile yağlayıcı preparatlar, kornea ve konjunktivanın ciddi hasar görmediği hafif ve orta dereceli KGS'li vakaların kontrol altına alınmasında rutin olarak kullanılmaktadır77. Bu vakalarda yapay gözyaşı preparatlarının uygulanmasındaki amaç, oküler yüzeyin nemlenmesini ve yağlanmasını sağlamak77, gözyaşı komponentlerinin eksikliğini gidermek, yangı öncesi maddelerin dilüsyonunu sağlamak, gözyaşı osmolaritesini azaltmak ve gözü osmotik strese karşı koruyarak hastalığın semptomlarını hafifletmektir1,77,78. Son yıllarda bu grup ajanlardan olan sodyum hyaluronatın (SH) sıklıkla kullanılmaya başlandığı görülmektedir78.
SH, yangı önleyici aktivitesi olan, doğal olarak meydana gelen viskoelastik bir maddedir78. Aragona ve ark.79, SH içeren yapay gözyaşı preparatlarının KGS olgularında oküler yüzey hasarı üzerine olan etkilerini araştırmak amacıyla, olgulara 3 ay boyunca günde 4-8 damla SH uygulamışlar ve çalışmanın sonucunu bulbar impresyon sitolojisi, slit lamp muayenesi ve hastalığın klinik semptomları gibi parametreler yönünden değerlendirmişlerdir. Tedavi süresince ajanın iyi tolere edildiği, herhangi bir yan etkiye neden olmadığı ve tedavinin 3. ayında olgularda impresyon sitolojisi yönünden önemli iyileşmeler sağlandığı rapor edilmiştir. Sonuç olarak SH içeren yapay gözyaşı preparatlarının oküler yüzey hasarını önlemede faydalı etkileri olduğu vurgulanmıştır79.
Kortikosteroidler: KGS'nin patogenezisinde yangısal süreç anahtar rol oynamaktadır. Bu sürecin durdurulması veya önlenmesi hastalığın iyileştirilmesi açısından önemlidir80. Bu amaçla kortikosteroidler gibi güçlü anti-inflamatuar ajanlar sıklıkla kullanılmaktadır19,81. Kortikosteroidler; preinflamatuar şemokin ve sitokinlerin üretimini, MMP-9 ve prostaglandin gibi yangının lipid mediatörlerinin sentezini ve ICAM-1 salınımını azaltarak, lenfosit apoptozisini stimüle ederek19 ve nüklear faktör gibi bazı preinflamatuar genlerin transkripsiyonel regülasyonunu engelleyerek76 yangıyı önlemektedir.
Son dönemlerde insan ve hayvanlar üzerinde yapılan birçok çalışmada; metilprednisolon66, deksametazon82, fluorometanol (FML)76,80,81 ve loteprednol etabonat83 gibi kortikosteroid grubu anti-inflamatuar ajanların KGS vakalarında etkin sonuçlar verdiği rapor edilmiştir76,81.
FML tedavisi sonrası konjunktival ve korneal sinirlerin göz kırpma refleksiyle daha iyi uyarılabildiği81, reflektorik gözyaşı miktarının normale döndüğü, gözyaşının kalitatif ve kantitatif olarak düzeldiği görülmüştür. Bu durum, gözdeki yangının azalması, oküler yüzeydeki lezyonların düzelmesi ve konjuktival goblet hücre sayısındaki artışa bağlanmıştır84. Yang ve ark.81, FML uygulaması sonrası KGS'li hastaların görme yeteneğindeki belirgin düzelmenin korneal hasardaki azalma ile korneal parlaklığın ve PGF stabilitesinin artmasından ileri geldiğini iddia etmişlerdir.
KGS vakalarının % 1'lik metilprednisolonla yapılan tedavisinde 2 hafta sonra hastalığın şiddetinde %43-57 arasında değişen bir iyileşme sağlandığı ve olgularda fluorescein boyanma alanlarının azaldığı rapor edilmiştir. Çalışma sonucunda metilprednisolon tedavisinin, yapay gözyaşı preparatlarının yoğun bir şekilde kullanılmasına rağmen sonuç alınamayan ileri derecelerdeki KGS vakalarında etkili bir tedavi seçeneği olduğu vurgulanmıştır. Ancak uzun tedavilerde intraoküler basınç artışı ve katarakt oluşumu gibi komplikasyonlar şekillenebileceğinden tedavi süresince olguların dikkatli bir şekilde izlenmesi gerekmektedir66.
Vitamin-A Preparatları: Vitamin-A, normal epitelyal gelişim için esansiyel bir öneme sahiptir. Oküler rahatsızlıklar üzerine olan etkisi hakkında farklı görüşler bulunmaktadır77. Retinoik asit türevi olan retinolun gözyaşında mevcut olması, oküler yüzey epitelyumuna başlıca lakrimal bez tarafından sağlandığını göstermektedir85. KGS'ye bağlı lakrimal bezin disfonksiyonu oküler yüzeyde retinol eksikliğine ve keratinizasyona neden olmaktadır77.
Koruyucu özellikteki ajanlara ve yapay gözyaşı preparatlarına cevap vermeyen KGS olgularının tedavisinde retinol palmitat oftalmik solüsyonunun etkisi; keratinize, non-keratinize, goblet ve yangısal hücrelerin ölçümü gibi sitolojik parametreler yönünden değerlendirilmiştir. Çalışmanın sonucunda non-keratinize ve goblet hücre sayısında artış gözlenirken, keratinize hücre sayısında ise azalma saptanmıştır86.
Tseng ve ark.87, lokal retinoik asitin KGS üzerine olan etkisini araştırdıkları çalışmalarında, bu ajanın olguların tümünde rose bengal boyanma, SGT ve hastalığın klinik belirtileri üzerine faydalı etkisi olduğunu bildirmişlerdir. Ancak başka bir çalışmaya göre %0.01'lik tretinoin tedavisi, impresyon sitolojisi ve hastalığın klinik belirtileri yönünden placebo uygulanan kontrol grubuna göre önemli farklılıklar göstermemektedir88.
İmmunomodülatörler: Son yıllarda, yangısal mediatörleri spesifik olarak hedefleyen tedavi şekillerinde artan bir trend görülmektedir80. KGS'nin patogenezisinde yangısal sürecin varlığı, hastalığın tedavisinde CsA gibi immunomodülatör ve anti-inflamatuar etkili ajanların kullanımını doğurmaktadır84. CsA, yangısal sitokin üretimi ve T hücre aktivasyonu ile mast hücre, eozonofil ve antijen ihtiva eden hücrelerin infiltrasyonunu önleyen89, apoptozisi inhibe eden immun-apoptotik markırları azaltan19,89, aköz gözyaşı üretimi ve konjunktival goblet hücre dansitesini ise arttıran (90) bir ajandır.
KGS vakalarında %0.05'lik CsA'nın etkisinin araştırıldığı bir klinik çalışmada; hafif dereceli olguların %74.1'inde, orta dereceli olguların %72.4'ünde, ileri derecedeki olguların %66.4'ünde ve toplam olguların ise %72.1'inde iyileşme gözlenmiştir91. Orta dereceden şiddetliye kadar değişen 32 KGS'li olguda lokal CsA'nın etkilerinin araştırılmasında, tedavi sonunda konjunktival lenfositik ile lenfosit aktivasyon markırlarının sayısında önemli azalmaların olduğu bildirilmiştir92. KGS'li vakalardan alınan konjunktival biyopsi örneklerinin PAS ile boyanarak değerlendirmesinde lokal CsA'nın konjunktival goblet hücre sayısını arttırdığı, epitelyal hasarı azalttığı ve epitelyumun proliferatif aktivitesi üzerine olumlu etkisinin olduğu tespit edilmiştir93. Benzer bir sonuç, orta dereceden şiddetliye kadar değişen KGS hastalarının konjunktival epitelyumlarında IL-6 seviyeleri üzerine CsA göz damlasının etkisinin araştırıldığı bir diğer çalışmada da alınmıştır94.
Tetrasiklinler: Doksisiklin; prostat kanser hücrelerinde, epidermal keratinositlerde, endotelyal hücrelerde ve korneal epitelyal hücrelerde MMP-9 aktivitesini inhibe eden uzun etkili semisentetik yapıda olan tetrasiklin grubu bir antibiyotiktir95-98. KGS'de korneal yüzey düzensizliklerinin gelişimini önler ve apikal korneal bariyer fonksiyonunu korur99. Yangısal sitokinlerden olan IL-1β'nın üretimini ise inhibe eder100.
KGS üzerine yapılan bir çalışmada, karboksimetilsellüloz sodyum, FML, nepafenak, ketorolak, bromfenak, diklofenak ve doksisiklinin farklı göz parametreleri üzerine etkileri araştırılmıştır. Çalışmanın sonunda, doksisiklin ile tedavi edilen gruplarda aköz gözyaşı üretimi yönünden önemli bir düzelmenin olmadığı ancak gerek dakikadaki gözkırpma sayısı gerekse korneal fluorescein boyanma alanları gibi parametreler yönünden önemli iyileşmelerin olduğu tespit edilmiştir. Doksisiklinin faydalı etkisinin korneal epitelyumda hiperosmolariteden kaynaklanan MMP üretimini baskılamasına bağlı olabileceği öne sürülmüştür76.
Mast Hücre Stabilizatörleri: Olopatadine, antihistaminik ve mast hücre stabilizatörüdür73,74. Bu ajan; yanma, batma, kızarıklık ve kaşıntı gibi oküler belirtilerin önlenmesi amacıyla başta allerjik konjunktivitis olmak üzere yangı ile seyreden göz hastalıklarının tedavisinde kullanılmaktadır101. Bazı araştırmacılar, bu ajanın allerjik konjunktivitis ile ortak klinik belirtilere sahip olan KGS'nin tedavisinde kullanılmasında faydalı sonuçlar alınabileceğini belirtirken73,101; bazıları ise olumlu bir etkisinin olmadığını öne sürmüşlerdir74,102. Villareal ve ark.102'na göre olopatadine farelerde gözyaşı üretim miktarını azaltmaktadır. Lekhanont ve ark.74 ise deneysel olarak oluşturdukları bir KG modeli üzerine bu ajanın faydalı etkisinin olmadığını tespit etmişlerdir.
Operatif Tedavi: Hayvanlarda KGS'nın operatif tedavisinde; parotis kanal transpozisyonu (PTK), kalıcı kısmi tarsorafi ve nazolakrimal punkta oklüzyonu gibi tekniklerden yararlanılmaktadır77. Parotis bezi transpozisyonunun, salivasyonu sağlayıcı; kalıcı kısmi tarsorafinin, gözkırpmayı azaltıcı; nazolakrimal punkta oklüzyonunun ise gözyaşının muhafazasını sağlayıcı etkileri vardır. En fazla tercih edilen teknik ise PTK'dır4.
PTK; insanlarda KGS'nin tedavisinde ilk olarak 1950 yılında denenmiştir. Daha sonra bu tekniği 1966 yılında Lavignette veteriner cerrahide kullanmıştır. PTK'nın, medikal tedavilere cevap vermeyen ileri derecedeki KGS'li hastalarda uygulanması önerilmektedir4. Hastalığın medikal tedavisinde CsA'nın kullanılmasıyla birlikte PTK ile tedavi edilen hastaların sayısında ciddi bir azalma görülmüştür4,103. Teknik, lateral (açık) ve oral (kapalı) cerrahi yaklaşım olmak üzere 2 şekilde yapılmaktadır4,7. Lateral cerrahi yaklaşımdaki amaç, parotid kanalı üzerinden çene bölgesinden yapılan bir ensizyon ile açığa çıkarılan kanalın, subkutan tünel vasıtasıyla konjunktival forniksten geçirilerek konjunktival keseye transplante edilmesidir. Oral cerrahi yaklaşımda ise tek fark ensizyonun oral yolla yapılmasıdır4.
Sonuç olarak, kuru göz sendromunun tedavisinde, klinik belirtilerin önlenmesi, başta yangı olmak üzere hastalığın patogenezisinde rol oynayan etiyolojik faktörlerin ortadan kaldırılması veya her ikisine yönelik medikal yöntemler kullanılmaktadır. Klinik belirtilerin kontrol altına alınması için yapılan semptomatik tedavi seçeneklerinin ömür boyu ve sık aralıklarla uygulanması hasta ve hasta sahibi için yorucu olmakta ve ülke ekonomisine yüksek maliyetler getirmektedir. Bu nedenle son yıllarda yapılan klinik ve deneysel çalışmaların hastalık sürecinde rol oynayan yangı, hiperosmolarite ve evaporasyon gibi faktörler üzerine yoğunlaştığı görülmektedir. Mevcut derlemede KGS, güncel çalışmalar ışığında kapsamlı bir şekilde değerlendirilmiş ve tedavi seçenekleri detaylı bir şekilde anlatılmıştır. Bu derlemenin göz hastalıkları alanında çalışan genç akademisyenler ile küçük hayvanlar üzerine pratik yapan tüm klinisyenlere faydalı olacağı kanısına varılmıştır.