Çeşitli dokularda ölçülen arginaz enzimi, maksimum
aktiviteye ulaşmak için inkübasyondan önce Mn
+2 iyonları
ile ısı aktivasyonu (preinkübasyon) gerektirir
9-11.
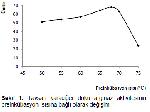
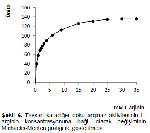
Tavşan karaciğer doku arginazının 68 °C'de Mn
+2
iyonları ile preinkübasyonu maksimum aktivite
oluşturmuş ve bu sıcaklıktan sonra enzim aktivitesinde
düşme meydana geldiği için optimum preinkübasyon ısısı 65 °C olarak alınmıştır (Şekil
1). Optimum preinkübasyon
ısısı, diabetik ve kontrol ratlarının karaciğerinde 68 °C
9, insan
12 ve koyun
13 karaciğer arginazı için bu
çalışmaya benzer olarak 60-65 °C olarak bildirilmiştir.
Farklı türlerde karaciğer dışındaki dokularda çalışılan
arginazların optimal preinkübasyon sıcaklıkları 55 °C
civarında bulunmuştur
12,14,15. Bu bulgular Mn+2
iyonları varlığında karaciğer arginazının diğer doku
arginazlarından yükselmiş ısıya karşı daha dayanıklı ve
dirençli olduğunun göstergesidir.
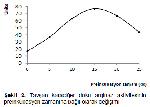
Arginazın aktivasyonunda preinkübasyon ısısı kadar
preinkübasyon süresi de önemlidir. 65 °C'de 15 dakikalık
preinkübasyon tavşan karaciğer doku arginazının
aktivitesini yaklaşık 4 misli artırmıştır (Şekil 2). Farklı tür
ve dokularda çalışılan arginazların preinkübasyon
sürelerinin 5 ile 20 dakika arasında değiştiği bildirilmiştir9,10,12-15. Tavşan karaciğer doku arginazının en
uygun preinkübasyon süresinin 13 dakika olduğu tespit
edilmiş olup bu değer diğer dokular için belirtilen
preinkübasyon süresi sınırları içerisindedir. Tüm bu
çalışmalara zıt olarak rat böbrek arginazının aktivasyonu
için preinkübasyon ısısı ve süresinin gereksiz olduğu
bildirilmiştir9.
Bir metalloenzim olan arginazın tam katalitik aktivite
gösterebilmesi, subunitelerine ayrılmaması ve kuaterner
yapısının şekillenmesi için her subünitenin bir mol Mn+2
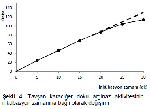
içermesi gerekir16,17. Preinkübasyon ısısının Mn+2
iyonlarına gereksinimini tespit etmek için enzim kaynağı
MnCl2'lü ve MnCl2'süz (distile su ile) preinkübasyona
tabii tutulmuştur. MnCl2'lü preinkübasyon uygulanan
enzim kaynağının, MnCl2'süz preinkübasyon uygulanan
enzim kaynağından yaklaşık 4 kat daha fazla aktivite
gösterdiği saptanmıştır (Şekil 4). Tavşan karaciğer
arginaz aktivitesi için de preinkübasyon ve Mn+2 iyonları
gereklidir. Mn+2'nın preinkübasyon sırasında arginaza
bağlanarak enzim aktivitesini ve dayanıklılığını artırdığı
açıklanmıştır10,11,17. Mn+2 iyonlarının enzim ile
substrat arasında metal bir köprü kurduğu ve enzim-
Mn+2-arginin kompleksinin oluşmasının enzimi aktive
ettiği bildirilmektedir18. Bu konu ile ilgili çalışmalarda
ortak nokta Mn+2'nın arginaz aktivitesinde vazgeçilmez
bir kofaktör olması ve optimal Mn+2 derişiminin dokuya
göre farklılık göstermesidir10,11,16-18.
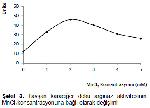
Enzimatik reaksiyonlar vücut ısısında oluştuğu için
enzim kaynağı 37 °C'de 0-30 dakikalar arasında
inkübasyona bırakılarak optimum inkübasyon süresi
tespit edilmeye çalışılmış, 18. dakikaya kadar lineerliğin
devam ettiği, 18. dakikadan sonra ise lineerliğin yerini
hiperbolik bir görünümün aldığı gözlemlenmiştir (Şekil 4).
Enzim aktivitesindeki lineer artışın 18. dakikadan sonra
lineerlikten sapması reaksiyon sonucu oluşan ornitin ve
ürenin, enzimin inhibisyonuna (ürün inhibisyonu) neden
olmasından kaynaklanabilir19,20.
Farklı tamponlar ve farklı pH'lar kullanılarak memeli
arginazlarının bazik optimum pH'a (9.5-10.5) sahip
olduğu gösterilmiştir10-13,15,18. Tavşan karaciğer
doku arginazı için en yüksek aktivite pH 10-10.1'de
sodyum bikarbonat-sodyum karbonat tamponu varlığında
bulunmuştur (Şekil 5).
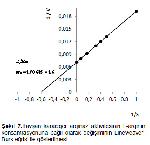
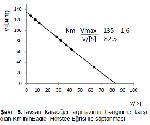
Tavşan karaciğer doku arginazının L-arginine karşı
olan Km değeri 1.6 mM olarak bulunmuştur (Şekil 6).
Yapılan çalışmalarda farklı türlerden karaciğer
arginazının L-arginine karşı olan Km' inin geniş sınırlar
içinde değiştiği görülmüştür. Km değeri fascioliosisli
koyunlarda 4 mM13, insanlarda 4.1 mM12, diabetik
ve normal ratlarda 3.2 mM9, kobaylarda 19.6 mM21
olarak bulunmuştur. Tavşan karaciğer doku arginazı için
tarafımızdan bulunan Km değeri diğer çalışmalarda elde
edilen Km değerlerinden daha düşüktür.
Tavşan dokularındaki arginaz aktivitelerinin tespit
edildiği bu çalışmada en yüksek arginaz aktivitesi diğer
memeli türlerinde olduğu gibi1,2 karaciğerde tespit
edilmiştir. Lisowska-Myjak ve ark.22 31 türün bağırsak
arginaz aktivitesinin türden türe 2 ile 100 misli arasında
geniş bir farklılık gösterdiğini ve en yüksek aktivitenin
tavşan, rat, hamster ve farelerde olduğunu tespit etmiştir.
Fare ve ratların tükürük bezlerinde arginaz aktivitesinin
değişen seviyeleri bulunurken tavşan ve kobayın tükürük bezlerinin hemen hemen hiç arginaz aktivitesine sahip
olmadığı kaydedilmiştir23.
Primatlarla karşılaştırıldığında (maymun, orangutan,
gorilla, insan) primat olmayan türlerde (fare, rat, tavşan,
kedi, köpek) eritrosit arginaz aktivitesi tespit
edilemeyecek seviyelerde (<1.0 μmol üre / g Hb / saat)
bulunmuştur24. Bu çalışmada ise eritrosit arginaz
aktivitesini 3.22±0.60 μmol üre / g Hb / saat) olarak tespit
edildi.
Yapılan taramalarda tavşan karaciğer doku
arginazının kinetik özellikleri ile ilgili bir çalışmanın
yapıldığı literatüre rastlanmamıştır. Bu nedenle tavşan
karaciğer dokusunda arginaz enziminin kinetik özellikleri
araştırılmış, tavşan karaciğer arginazının aktivasyonu
için preinkübasyonun ve Mn+2 iyonlarının gerekli olduğu
saptanmıştır. Sonuç olarak elde edilen verilerin enzimin
fizyolojik rolleri ile ilgili yapılacak araştırmalara ışık
tutacağı kanaatine varıldı.