Kemik greftleri, kemik iyileşmesini hızlandırmak amacıyla travmalar, kemik tümörlerinin eksizyonu, gecikmiş kaynama, nonunion, ostektomiler, artrodez ve çok parçalı kırıklar sonucunda oluşan geniş kemik defektlerinin onarımında yaygın olarak kullanılmaktadır. Otogreftler, allogreftler, ksenogreftler, polimerler, seramikler ve bazı metaller kemik grefti yerine kullanılabilen materyaller arasında sayılmaktadır. Kemik greftleri osteogenezis, osteoindüksiyon ve osteokondüksiyon amacıyla kullanılmaktadır
1-8.
Otojen kemik greftleri diğer kemik greftleri ve kemik grefti yerine geçen materyaller ile kıyaslandığında hala “altın standart” olarak tanımlanmaktadır. Otojen kemik greftleri optimum osteogenezis, osteoindüksiyon ve osteokondüksiyon özelliklerini taşımakla birlikte, hastalık transfer riskini ve implantasyon sonrası rejeksiyon ihtimalini de ortadan kaldırmaktadır. Bu avantajlara rağmen greftlerin elde edilmesi sırasında gözlenebilen donör bölge morbiditesi, kan kaybı ve greftlerin sınırlı miktarda elde edilmeleri gibi sorunlarla sık olarak karşılaşılmaktadır. Otojen kemik greftlerinin elde edilmesi ve kullanılmasındaki bu eksiklikler alternatif greft uygulamaları üzerinde çalışmaların yapılması gerekliliğini ortaya koymaktadır1-5,9-179.
Allogreftler benzer türler arasında bir bireyden diğer bireye uygulanan greftlerdir. Genellikle kadavralardan elde edilir ve kemik bankalarında saklanırlar. Bu tür greftler konakçı dokunun büyümesini sağlayan yapısal bir iskele görevi görürler ve osteoindüktif özellikleri vasattır3,5,18. Allojen kemik greftlerinin hastalık transferine neden olması ve rejeksiyon ihtimali dezavantajları arasında sayılmaktadır3,5.
Kemik greftlerinin yetersiz olduğu durumlarda ya da olumsuz özelliklerinden sakınabilmek amacıyla kemik greftleri yerine geçebilecek materyaller üzerindeki çalışmalar halen devam etmektedir1-3,7.
Alternatif kemik greft materyalleri arasında sayılan biyoseramikler nispeten zayıf çekme özelliklerine sahip olmakla birlikte basınca karşı mükemmel derecede dayanıklı, aşınmaya karşı yüksek dirençli, biyouyumlu, sert ve kırılgan malzemeler olarak kabul edilirler. Fizyolojik ortamlarda polimerik malzemelere karşı üstün bir yük taşıma yüzeyi sağlarlar. Tek başına, organik veya polimerik malzemeler ile birlikte de kullanılabilen doğal ya da sentetik biyoseramikler replasman uygulamaları için en umut verici biyomalzemeler arasındadır5,8,18,19.
Koral (Deniz Mercanı)
Kemik grefti yerine kullanılabilecek, kemik defektine kolaylıkla adapte edilip, rahatça yerleştirilebilen, inert ve zamanla rezorbe edilebilen bir madde aranırken koral benzeri implantlar keşfedilmiştir19-28.
Koral, deniz tabanında koral poliplerince oluşturulmaktadır. Koral polipleri deniz suyunda bulunan kalsiyum ve karbonat iyonlarını absorbe ederek kalsiyum karbonat iskeletini biriktirmeye başlar10,13-17,29-33. Bu birikim arttıkça polip yukarı doğru itilir ve oluşan iskelet kısımları, canlı poliplerin kalıpları halinde kalır. İskeletteki porların birleşme yerleri, her bir polipin birbirleriyle ilişkisine izin verir10,12.
Spongiyöz kemik yapısına benzeyen ve birbirleriyle bağlantılı por yapısına sahip olan koralin bazı türleri kemik grefti olarak kullanılmaktadır1,2,10,11,18,34-40. Tanımlanan ikibinden fazla mercan türünden 14 adedi muhtemel kemik grefti yerine kullanılabilecek türler olarak tanımlanmıştır. Acanthastrea, Acropora, Favites, Fungia, Goniopora, Lobophyllia, Montipora, Pocillopora, Polyphyllia, Porites ve Turbinaria genusuna ait mercan türleri bunlar arasında sayılmaktadır (Şekil 1A, Şekil 1B)18,19.

Büyütmek İçin Tıklayın |
Şekil 1: A. Koral (Madracis sp), B. Koral’den bir kısım, C. Koral porlarının makroskopik görünümü, D. Koral porlarının mikroskopik görünümü (20 x). |
Korallerin farklı por çaplarına sahip türleri bulunmaktadır. Koral implant, kemik dokuya yerleştirildiğinde kemik formasyonunu ilerletir ve kemikle değişen oranlarda bağlantı kurar. Kemiği oluşturan hücrelerin koral implant içerisine tam olarak penetrasyonu, porların hacimleri ve porlar arası bağlantı bulunmasından kaynaklanır1,2,10,12,34. Por çapı 10 μm' den daha az olan koral yapıları hücrelerin invazyonunu engeller, 10-50 μm arasında olanlar ise fibrovasküler invazyonu stimüle eder. Greft materyali olarak kullanılacak koralin sahip olduğu por çapı hücre ve vasküler yapıların yerleşmesine izin verecek kadar en az 50-150 μm arasında olmalıdır. Por çapı 150 μm' den daha büyük olan koraller ise mineralize kemiğin invazyonunu kolaylaştırır2,40,41. Koralin lateral ve longitudinal olarak birbirleriyle ilişkili por yapısının (Şekil 1C, Şekil 1D) osteon formasyonu ve fibrovasküler büyüme için olumlu etkisinin bulunduğu bildirilmiştir8,40.
Kemik hücrelerinin implant boyunca iletimi için koral ile kemik dokunun tam olarak temas etmesi gerektiği, periost üzerine konulan implantın kemikle bağlantı kuramadığı bildirilmektedir3,36. Koralin yapısı kemik ile biyomateryal arasındaki değişim için mükemmel bir yüzey alanı sunmaktadır1,2,5,10,27,34,36,42-44. Koral içerisinde fibrovasküler doku proliferasyonu implantasyondan sonra 1-2 hafta içerisinde görülmektedir. Fibrovasküler dokunun kemiğe transformasyonu çevreden merkeze doğru oluşmakta, ilk olarak implant yüzeyindeki hücreler kemiğe dönüşerek yeni oluşan kemik por merkezine doğru ilerlemektedir20,23. Koralin longitudinal porları ve birbirleriyle ilişkili delikleri uzun mesafede dahi kan akışını engellememektedir. Bu yapısı koralin kan hücreleri tarafından hızlı bir şekilde invazyonuna veya kemik iliği hücreleri tarafından ekstravazasyonuna izin verir, bunu vaskülarizasyon izler. İmplantasyondan sonra 3 ay içinde %50-88 oranında lamellar kemikle dolan koral, kemik dokuyla sıkı bir şekilde bağlanmakta8,10 ve olgun lamellar kemik 3-6 ay içinde oluşmaktadır3. Kemik hücrelerinin tam olarak penetrasyonu 6 ayda tamamlanır. İmplante edilmeden önce gevrek karakterde olan koral, kemik hücrelerinin penetrasyonu tamamlandığında normal kemik kadar güçlü hale gelmektedir1-3,5,10,18-21,27,34,36,42-45.
Koral iskeleti %1 organik, %99 inorganik maddelerden oluşur, yapısındaki organik madde çok az olduğundan antijenik reaksiyon oluşturmaz1,2. Koralin özellikle kalsiyum ve eser elementler başta olmak üzere mineral içeriği kemikteki mineral içeriğine benzemektedir9,11,12,28,36,46. Bu eser elementler, mineralizasyon olgusunda, kemik hücreleri içinde oluşan enzimatik olayların başlatılmasında önemli rol oynamaktadır10,28,36,39,40. Kalsiyum karbonat (aragonit) yapısına sahip olan koral (Şekil 2) zamanla yerleştirildiği kemik doku içerisinde rezorbe olmaktadır3,11,14,21,28,43,47,48.
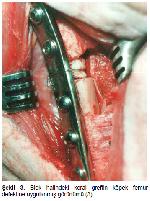
Biyouyumlu bir materyal olan koral spinal füzyon49,50, maksillofasial cerrahi (29, 33, 39, 51-54), dental cerrahi31,55 ve diğer ortopedik uygulamalarda14-17,48,56,57, tek başına29,33,48,52,53,55, veya başka bir kompozit materyal ile birlikte31,49,56 kullanılmış, başarılı sonuçları ve düşük komplikasyon oranları bildirilmiştir (Şekil 3)2,10,20,24,40,43,45,58-.
Koral direkt olarak kullanılabildiği gibi alternatif bir yöntem olarak hidroksiapatit'e (HA) dönüştürülerek te kullanılabilmektedir. Replamineform (replicated lifeform) olarak isimlendirilen yöntemle, kalsiyum karbonat (koral iskeleti), fosfatla hidrotermal değişim reaksiyonuna girerek kalsiyum hidroksiapatit'e (Ca10(PO4)6(OH)2) dönüştürülebilir. Oluşan materyal deniz mercanının tam kopyasıdır ve korallin hidroksiapatit, replamineform hidroksiapatit veya poröz hidroksiapatit olarak adlandırılmaktadır8,11,22,25,62-64. Ayrıca koral yüzeyi çeşitli fabrikasyon teknikleri ile yüksek basınç ve sıcaklık altında HA ile de kaplanabilmektedir. Ancak koralline hidroksiapatit çok az rezorbe edilebilme özelliği göstermektedir26,30,48,59.
Koral sınırlı osteoindüktif kapasiteye sahiptir29,65. Spinal füzyonda Biocoral/kollagen kullanımı koralin tek başına kullanımına göre solid füzyonla sonuçlanmıştır66. Kemik morfojenik proteini ilave edilen koral iskeleti aynı şekilde kemik defektlerinin iyileşmesini hızlandırmıştır61,67. Benzer sonuçlar Radius68 ve ulna38 defektlerinde de bildirilmiştir.
Koral rezorbe edilebilen bir yapıdadır ve osteoklastlar tarafından progresif olarak yıkımlanır. Koralin rezorpsiyonu, osteoklastlarda karbonik anhidrazla olmaktadır. Osteoklast-implant yüzeyleri arasındaki pH'nın lokal olarak düşük olması kalsiyum karbonat matriksinin çözülmesini sağlar. Koral implanttaki kalsiyum iyonları serbestleşir, presipite olur ve yeni kemikle birleşir10,36,40,43,69. Koral'in rezorpsiyonu kemik ile implantın temas alanlarında çok aktiftir ve sentripedal olarak ilerler70.
Koral implantasyonundan hemen sonra alınan radyografilerde, implantların iskelet yapılarının açıkça belirlenebildiği (Şekil 4), zaman içerisinde implantın ilerleyici rezorpsiyonu ve kemik hücrelerinin implant porları içerisine invazyonu ile intrinsik koral yapılarının belirginliğini kaybettiği belirtilmektedir3,7,12-17. Koralin blok şekli granül şekline göre daha uzun sürede rezorbe edilmektedir (Şekil 5). Buna rağmen histolojik olarak koral, implantasyondan 2 yıl sonra bile görülebilmektedir22,23,40.
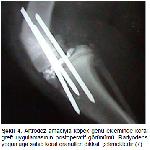
Büyütmek İçin Tıklayın |
Şekil 4: Artrodez amacıyla köpek genu ekleminde koral greft uygulamasının postoperatif görünümü. Radyodens yoğunluğa sahip koral granülleri dikkati çekmektedir7. |
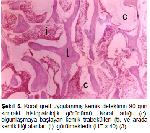
Büyütmek İçin Tıklayın |
Şekil 5: Koral greft uygulanmış kemik defektinin 90 gün sonraki histopatolojik görünümü. Koral artığı (c), olgunlaşmaya başlayan kemik trabekülleri (t), ve arada kemik iliği alanları (i) görülmektedir (HE x 40)3. |
Koral implantların herhangi yangısal bir reaksiyona, yabancı cisim dev hücrelerinin görülmesine ve rejeksiyona yol açmadığı12,40,44,51, koral'in dokularla uyumlu olduğu bildirilmektedir3. Koral kullanımının, kemik kavitelerinin doldurulmasında güvenilir olduğu ve implantların çok iyi tolore edildiği belirtilmiştir28,71.
Sonuç
Koral kemik greftleri yerine kullanılan osteokondüktif bir materyaldir ve implantasyonun erken dönemlerinde implantın kenarlarında alıcı kemik dokusundan kaynaklanan direkt osteoblastik aktiviteyi başlatmaktadır3,27,43. Koral kemik greftleri yerine tek başına kullanılabileceği gibi osteoindüktif özelliğe sahip diğer greft materyalleri ile birlikte daha etkili bir şekilde kullanılabilir.