Çevresel bir kirletici olan ve canlılar için toksisitesi iyi bilinen TCDD ile başta kemiriciler olmak üzere birçok hayvan türünde toksisite çalışmaları yapılmış ve özellikle sinir sistemi
21,22, kardiyovasküler sistem
23-26 üreme organları
10,27,28 endokrin sistem
29 ve diğer birçok sistemde belirgin toksik etkiler meydana getirdiği bildirilmiştir. Ratlarda yapılan çalışmalarda TCDD'nin subakut ve subkronik toksik etkilerini 46 ng/kg dozlarında gösterdiği bildirilmektedir
3. Deneysel çalışmalarda TCDD'nin akut toksisitesi aşırı kilo kaybı, timus bezinde atrofi, hepatik hipertrofi gibi durumlarla birlikte gelişen Wasting sendromu ile ortaya konmuştur
14. Bu çalışmada TCDD'nin dozu beyin ve kalpte belirgin bir oksidatif stres oluşturmak amacıyla 500 ng/kg gibi yüksek bir doz olarak belirlenmiş ve 30 gün süreyle subakut bir toksisite oluşturulmaya çalışılmıştır.
Oksidatif stres, oksidan-antioksidan dengenin oksidanlara doğru kayması sonucu görülür. Akut yüksek doz TCDD uygulaması sonucu çeşitli doku ve türlerde oksidatif stresin görüldüğü iyi bilinmektedir. Laboratuvar hayvanlarında TCDD maruziyeti sonucu oluşan oksidatif stresin ROS, lipit peroksidasyon ve DNA hasarında artışa neden olduğu gözlenmiştir22,30. Kopf ve ark.26'nın yaptığı çalışmada TCDD'nin subkronik uygulanması sonucu oksidatif stres parametreleri, kan basıncı ve kalp ağırlığında artışlara neden olduğu gösterilmiştir. Laboratuvar hayvanlarına TCDD uygulanmasının birçok dokuda lipit peroksidasyonun artışıyla beraber oksidatif strese neden olduğu çeşitli çalışmalarda gösterilmiştir30,31.
Çalışmalar TCDD detoksifikasyonunda antioksidanların etkisi üzerinde durmakta ve AhR agonistlerinin ise antioksidan kullanmaksızın tek başlarına yeterli etki göstermediklerini bildirmektedir6. Antioksidanlar genellikle ksenobiyotiklere cevap şeklinde veya çeşitli hastalık sonucu oluşan oksidatif strese karşı koruyucu amaçlı kullanılmaktadır21. Bu hedef doğrultusunda yapılan birçok çalışmada TCDD'nin meydana getirmiş olduğu hasarlara ve ROS'a karşı çeşitli antioksidanlar kullanılmıştır. Bu çalışmada ise ratlara TCDD uygulaması sonrasında beyin ve kalp dokusunda oluşacak hasarlara karşı melatonin uygulanarak, iyileşmeler sağlayıp sağlamayacağının belirlenmesi amaçlanmıştır. Melatonin etkili bir biçimde çeşitli reaktif oksijen ve nitrojen türleri ile etkileşime giren ve antioksidan enzimlerle prooksidan enzimleri düzenleyen güçlü bir antioksidandır13.
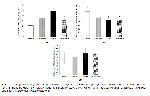
Lipit peroksidasyonun en önemli göstergelerinden olan MDA düzeylerinin özellikle serebral korteks ve hipokampusta TCDD tarafından önemli düzeylerde artırıldığı ve beynin diğer bölgelerinin ise fazla etkilenmediği belirtilmiştir3. Bir başka çalışmada ise 13 hafta boyunca farklı dozlarda uygulanan TCDD'nin B6C3F1 dişi ratlarda, doza bağlı şekilde sitokrom c azalmasıyla süperoksit anyon radikal üretiminde, lipit peroksidasyonunda ve DNA çift zincir kırılmalarında artışa neden olduğu görülmüştür30. Sakin ve ark.15'nın yaptıkları çalışmada ise ratlara uygulanan TCDD'nin doza bağlı olarak kalp, beyin, karaciğer ve böbrek dokularında MDA'yı artırdığı ve likopenin de bu etkiyi hafiflettiği gösterilmiştir. Bu çalışmada 500 ng/kg dozda TCDD'nin 30 gün süreyle uygulanması, tüm beyin ve kalp dokusunda önemli derecede MDA düzeylerinde artışlara neden olmuş ve meydana gelen MDA düzeylerindeki artışlar melatonin uygulamasıyla azaltılmıştır. Şahna ve ark.32'nın yaptığı bir çalışmada melatoninin fizyolojik ve farmakolojik konsantrasyonlarının miyokardiyal doksorubisin toksisitesine karşı koruyuculuk sağladığı, melatonin verilen ratlarda MDA seviyesinin kontrole yakın olduğu ve kalpteki morfolojik değişikliklerde iyileşmeler sağladığı görülmüştür. Önceki çalışmalara paralel olarak bu çalışmada TCDD uygulamalarının muhtemelen hücre membranlarında serbest radikal oluşumunu artırarak dokularda MDA düzeyinde artışlara yol açtığı ve lipit peroksidasyonuna neden olduğu, melatonin uygulamasıyla da yükselen MDA düzeylerinin azaldığı gözlenmiştir.
GSH hayvan hücrelerinde en çok bulunan hücre içi antioksidanlardan biridir ve endojen ROS ile eksojen oksidatif hasarı detoksifiye eder33. GSH düzeylerinin dokularda azalması birçok patolojik olayın varlığına işaret etmektedir34. Ayrıca GSH düzeyindeki azalma, vitamin C'nin yenilenmesi ve okside formdaki vitamin E'nin azalması üzerindeki rolünden dolayı da antioksidan sistem üzerinde etkilidir35. GSH düzeylerinin ksenobiyotiklere karşı verdiği tepki bazen azalarak bazen de yükselerek kendini gösterebilmektedir. Özellikle çok düşük miktarlarda TCDD'ye maruz kalan farelerde GSH düzeyinin arttığı, ancak yüksek doz TCDD uygulamasına karşı ise tükenmeye bağlı olarak miktarında azalmalar görüldüğü bildirilmektedir30. Subkronik TCDD uygulamasının beyinde GSH düzeyini azalttığı, ellagik asidin GSH seviyesini yükselttiği ancak vitamin E süksinatın beynin hiçbir bölgesinde GSH seviyesi üzerine etkili olmadığı gözlenmiştir21. Bu çalışmada ise TCDD'nin yüksek dozlarda uygulanmasına bağlı olarak GSH düzeyinin her iki dokunun kontrol grubuna kıyasla anlamlı bir şekilde azaldığı gözlemlenmiş (Şekil 1B, 2B), ancak melatonin uygulaması anlamlı bir yükselme sağlayamamıştır.
Aerobik hücrelerin peroksizomlarında bulunan ve hidrojen peroksiti su ve moleküler oksijene dönüştüren CAT, enzimatik antioksidan sisteminin önemli bir parçası olarak kabul edilmektedir36. Bazı çalışmalarda TCDD uygulaması CAT aktivitesini değiştirmişken, bazı çalışmalarda anlamlı değişiklik oluşturmamıştır. Günlük 10 ng/kg dozunda uygulanan TCDD'nin beynin hipokampus ve serebral korteks bölgelerinde CAT aktivitesinde yükselmeye neden olduğu ancak beyin sapında hiçbir değişikliğe neden olmadığı, 22 ile 46 ng/kg dozlarında uygulanan TCDD'nin ise CAT enzim aktivitesini bu bölgelerde baskıladığı görülmüştür22. Bir başka çalışmada ise TCDD uygulamasının kalp dokusunda CAT aktivitesinde herhangi bir değişikliğe neden olmadığı gösterilmiştir37. Ratlarla yapılan bir çalışmada 13 hafta süre ile farklı dozlarda TCDD ve antioksidan olarak likopen uygulanmıştır. Kalp dokusu CAT aktivitesinde gruplar arası fark gözlenmezken; karaciğer, böbrek ve beyin dokularında TCDD uygulamalarının katalaz aktivitelerinde önemli azalmalara neden olduğu gözlenmiştir15. Bu çalışmada ise tüm gruplar karşılaştırıldığında beyin ve kalp dokusunun her ikisinde de CAT aktivitesinde herhangi bir farklılığın olmadığı görülmüştür (Şekil 1C, 2C).
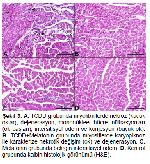
Toksikolojik çalışmalarda dioksinlerin rat ve farelerde kardiyovasküler etkilerinin olduğu, ayrıca fetal memeli kalbinin ise TCDD indüklü teratojenitede hedef organ olduğu gösterilmiştir. TCDD ya da PCB-126'nın veya dioksin benzeri PCB'lerin doza bağlı olarak kardiyomiyopati ve kronik aktif artrit gibi dejeneratif kardiyovasküler lezyonların görülme sıklığını artırdığı bildirilmiştir38. Benzer şekilde TCDD'nin kalp dokusunda nekroz ve kanamaya neden olduğu güçlü bir antioksidan olan protokateşuik asit uygulamasının kısmen koruyuculuk sağladığı belirtilmiştir39. Ratlarda okratoksin ile oluşturulan kalp ve akciğer hasarında melatoninin histopatolojik olarak iyileşmeler sağladığı gösterilmiştir40. Bir başka çalışmada ise ratlarda kurşunun böbrek ve karaciğer dokusunda neden olduğu hasara karşı melatoninin koruyucu etkilerinin olduğu bildirilmiştir.41. Bu çalışmada TCDD uygulamasının kalp dokusunda intersitisyel ödem, konjesyon, perivasküler hücre infiltrasyonu ve çeşitli nekrotik değişiklikler gibi patolojik hasarlara yol açtığı ve melatoninin bu hasarları hafiflettiği tespit edilmiştir (Şekil 3, Tablo 1). Sunulan çalışma bulguları ile anılan çalışma sonuçlarının benzer olduğu saptanmış; ek olarak bu çalışmada melatoninin TCDD'nin kardiyotoksik etkisini azalttığı ortaya konmuştur.
Bu çalışmada TCDD'nin beyin ve kalp dokusunda oksidatif ve histopatolojik hasarlara neden olduğu, güçlü bir antioksidan olan melatoninin TCDD toksisitesine karşı koruyucu olduğu ve oluşan hasarları azalttığı görülmüştür. Melatoninin bu olumlu etkilerini serbest radikal süpürücü ve antioksidan özellikleriyle gösterebildiği düşünülmektedir. Sonuç olarak çeşitli ksenobiyotikler tarafından oluşturulan oksidatif strese karşı melatonin gibi antioksidan maddelerin kullanımı önerilebilir.