Gıda kaynaklı virüsler; viral gastroenteritler (norovirüs, rotavirüs, astrovirüs) ve viral hepatitisler (Hepatit A ve E) olmak üzere iki gruba ayrılmaktadır
1,2. Viral hepatitlerden Hepatit A ve Hepatit E enterik yolla bulaşan, dünya genelinde sporadik ve endemik olgularla seyreden hastalıklardır
3. Gıda kaynaklı viral enfeksiyonlarda bulaşma başlıca fekal-oral yolla gerçekleşmektedir. Bulaşma yollarından en önemlisini ise enfekte personel tarafından hazırlanan çiğ veya yeterince pişirilmeden tüketilen ya da pişirildikten sonra kontamine olan gıdalar oluşturmaktadır
1. Kontamine gıda tüketiminden sonra oluşan enfeksiyonların şiddeti virüsün stabilitesine, enfekte personel tarafından saçılan virüs miktarına, gıdanın herhangi bir işlem görüp görmediğine ve konakçının duyarlılığı gibi çeşitli faktörlere bağlıdır
4.
Hepatit A ve Hepatit E Virüslerinin Genel Özellikleri
Hepatit A virüsü (HAV) Picornaviridae ailesinin Hepatovirüs genusunun bir üyesidir. Tek sarmallı RNA’ya sahip, zarfsız, 27-28 nm çapındadır5-7. HAV’ın antijenik olarak tek bir serotipi ve yedi genotipi (I, II, III, IV, V,VI, VII) vardır. Genotip I, II, III ve VII insanlarda enfeksiyon oluştururken, genotip IV, V, VI ise maymunlarda enfeksiyon oluşturmaktadır. İnsanlardan en sık izole edilen genotipler ise I ve III’tür8-10. İnsanlar, HAV’ın en önemli kaynağı olarak kabul edilmektedir. Bununla beraber insan dışında konaklar da vardır. Goril, orangutan, şebek ve diğer maymun türlerinde HAV’a karşı antikorlar tespit edilmiştir7,9.
HAV diğer picornavirüslere oranla olumsuz çevre koşullarına oldukça dayanıklıdır. Düşük pH seviyelerinde oldukça stabildir. Oda sıcaklığında ve pH 1’de virülens özelliklerini 5 saat kadar koruyabilmektedir. Virüs konvansiyonel kaynatma işlemi ile (~100°C) 5 dakikada inaktive olurken, nötral pH’da (pH=7) 60°C’de 60 dakikada etkilenmemekte ve 10-12 saat aynı sıcaklıkta tutulmasıyla sadece kısmi bir inaktivasyon sağlanmaktadır. Oda sıcaklığında 4 hafta inkübe edildiğinde enfektivitesi 100 kat azalmaktadır. HAV kuru ortamlarda da oldukça dayanıklıdır ve 25°C’de %42 nemli ortamda en az bir ay, -20°C’de ise yıllarca enfektif kalabilmektedir. Etken tatlı sularda, kaynak suyunda, deniz suyunda, atık sularda, kayalarda, midye ve istiridyelerde aylarca canlılığını sürdürebilmektedir7,9,10.
Hepatit E virüsü (HEV) Hepeviridae ailesi içerisinde, Hepevirüs genusunda sınıflandırılmaktadır ve bu ailenin tek üyesidir. HEV 27-34 nm çapında pozitif polariteli, tek sarmallı, zarfsız virüstür11-15. HEV’in tek bir serotipi ve 4 genotipi (genotip I, II, III, IV) vardır. Genotip I, Asya ve Afrika’da yer alan gelişmekte olan ülkelerdeki endemik türleri, genotip II Meksika ve Afrika’da, genotip III Amerika, birkaç Avrupa ülkesi ve Japonya ile Dünya genelinde sporadik vakalardan izole edilen türleri barındırmaktadır. Genotip IV ise başlıca Asya ülkelerinde insan ve evcil domuz türlerinde görülmüştür16-18.
Epidemiyoloji
HAV başlıca fekal-oral yolla bulaşmakta, bulaşma ya kişiden kişiye direkt temasla ya da kontamine su veya gıdanın alınmasıyla olmaktadır. Asemptomatik ve anikterik kişiler, özellikle de çocuklar, dışkılarında yüksek oranda ve uzun süre HAV saçılımı yaptıkları için hastalığın bulaşmasında önemli kaynaktırlar19.
Hastalık Kontrol Merkezi (CDC) her yıl Amerika Birleşik Devletleri’nde yaklaşık 143 bin, Dünya’da ise yaklaşık 1.43 milyon Hepatit A enfeksiyonu görüldüğünü bildirmektedir. Hastalık en fazla Akdeniz’e kıyısı olan ülkeler ile Afrika ülkeleri gibi gelişmekte olan ülkelerde görülmekte, en az oranda ise İskandinav ülkeleri, Japonya ve Avustralya’ da görülmektedir20. Dünya, Hepatit A görülme sıklığına göre yüksek düzeyde endemik, orta düzeyde endemik ve düşük düzeyde endemik bölgeler olmak üzere 3’e ayrılmaktadır. Yüksek düzeyde endemik bölgelerde (Afrika, Asya, Orta ve Güney Amerika) 10 yaşın altındaki çocukların %90’dan fazlası seropozitiftir. Orta düzeyde endemik bölgelerde (Güney ve Doğu Avrupa, Ortadoğu’nun bazı bölgeleri ve gelişmekte olan ülkelerin büyük bir kısmı) 20 yaşın altındaki bireylerde %80’den fazla, düşük düzeyde endemik bölgelerde (ABD, Batı Avrupa, Norveç, Japonya, Avustralya ve Kanada) ise 15 yaşından küçük çocuklarda %70 civarında seropozitiflik bildirilmiştir21.
Türkiye, Hepatit A enfeksiyonu bakımından orta düzeyde endemikliğe sahip ülke olarak değerlendirilmektedir22. Sağlık Bakanlığı’nın 2005 verilerine göre HAV’ın morbidite oranı 12.8/100.000 ve mortalite oranı ise 0.03/1.000.000’dir23. Türkiye’de yaşa ve bölgelere göre değişmekle beraber anti-HAV IgG seroprevalansının %85-100 arasında olduğu belirtilmiştir. Ancak adolesan bireylerde anti-HAV IgG seropozitiflik düşük olduğu için Türkiye orta endemik bölgede sınıflandırılmaktadır24.
Hepatitis A enfeksiyonunun inkübasyon süresi 15 ile 50 (ortalama 30) gündür. Hastalığın semptomları arasında koyu renkli idrar, ikterus, yüksek ateş, baş ağrısı, halsizlik, yorgunluk, iştahsızlık vardır9. Hepatit E enfeksiyonunda ise inkübasyon periyodu 15 ile 60 (ortalama 40) gündür. Hastalığın semptomları arasında yüksek ateş, halsizlik, sarılık, idrar renginde koyulaşma, bulantı, karın ağrısı, kusma, hepatomegali, kil renginde gaita, iştahsızlık yer almaktadır. Hepatit E enfeksiyonlarında mortalite oranı genel populasyonda %0.5-4 arasında, gebelikte ise %10-42 arasındadır3.
Gıda kaynaklı Hepatit A vakalarının yaklaşık %50’sinde enfeksiyonun kaynağı tespit edilememektedir19. Kabuklu deniz ürünleri, ahududu, çilek, pastacılık ürünleri, salatalar, sandviçler, çiğ sebzeler, dondurma, peynir, sütlaç, meyve suları, ekmek, krema, çiğ süt gibi ürünler Hepatit A salgınlarında önemli rol oynamaktadır25-28. Deniz kabukluları metabolizmaları gereği deniz suyunu filtre ederek beslenmekte ve bundan dolayı bünyelerinde çok miktarda etkeni barındırabilmektedirler. Kirli sularda yetiştirilen veya avlanan deniz kabukluları, Hepatit A salgınları açısından önemli bir kaynak teşkil etmektedir29,30. Dünya genelinde bildirilen Hepatit A olgularının yaklaşık %7’si deniz kabuklularının tüketimiyle ilişkilendirilmektedir31. Ayrıca çiğ sebze ve meyvelerin kontaminasyonu, ürünlerin yetiştirilmesi, işlenmesi, dağıtımı ve hazırlanması gibi aşamalarda gerçekleşmektedir. Kontaminasyon, genellikle enfekte personel tarafından uygun olmayan hijyenik koşullarda hazırlanmış yiyecekler ya da kanalizasyonun sularının tarımsal sulamada kullanılmasından dolayı ürünlerin yetiştirilmesi esnasında olabilmektedir6,28,32.
HEV’in epidemiyolojisi HAV ile benzerlik göstermektedir. HEV, alt yapının ve hijyen koşullarının yetersiz olduğu gelişmekte olan ülkelerin çoğunda önemli halk sağlığı sorunlarına neden olmaktadır. Bu ülkelerde akut viral hepatitlerin %50’den fazlasından Hepatit E sorumlu tutulmaktadır13. Asya’nın büyük bir kısmı, Afrika ve Latin Amerika Hepatit E bakımından endemik bölgeleri oluşturmaktadır. Söz konusu endemik bölgelerde yaklaşık 2 milyar insanın yaşadığı tahmin edilmektedir33. Hepatit E, ılıman iklime sahip ülkelerde genellikle kasım, aralık, ocak aylarında kendini gösterirken, endemik bölgelerde ise yıl boyu görülmektedir. Su kaynaklı salgınların büyük çoğunluğu yağmur sezonlarında ya da hemen sonra ortaya çıkmaktadır34. HEV’de gıdalar dışında kan ve kan ürünleriyle, kişiden kişiye, vertikal yolla ve zoonotik bulaşma da görülebilmektedir13,16.
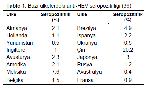
Hepatit E genotip I Asya’da Kamboçya, Çin, Hindistan, Pakistan, Özbekistan ve Vietnam; Afrika’da Cezayir, Orta Afrika Cumhuriyeti, Sudan, Tunus, Namibya Mısır, Fas ve Güney Afrika’da rastlanmaktadır. Genotip II, Meksika, Orta Afrika Cumhuriyeti, Mısır ve Nijerya gibi ülkelerde görülmektedir. Genotip III ise sporadik akut hepatit vakalarından ve evcil domuzlardan izole edilen türleri barındırmaktadır35. Genotip IV ise Asya ülkeleri ile sınırlı olmakla beraber insan ve evcil domuzlardan izole edilen türleri kapsamaktadır. Japonya, enfekte insanlardan 3 genotipin ( I, III ve IV) izole edildiği tek ülke olmasına rağmen, genotip I’in bu ülkeye ait olmadığı başka bir ülkeden gelmiş olabileceği tahmin edilmektedir35. Dünya’da bazı ülkelerde anti-HEV seropozitiflik oranları Tablo 1’de gösterilmiştir.
Türkiye’de yapılan çalışmalarda anti-HEV seroprevalansı İstanbul’da %4.8-5.3; Trabzon’da %3; İzmir’de %3.5; Bursa’da %9-10.4; Antalya’da %11.1; Malatya’da %9.3-9.8; Erzurum’da %10.3; Elazığ’da %11.6; Edirne’de %2.4; Denizli’ de %11.3 ve Ankara’da %3.8-7.6 olarak bulunmuştur37.
HEV’in deneysel olarak insanlardan evcil domuzlara geçişi gerçekleştirildikten sonra hastalığın zoonoz olabileceği düşünülmeye başlanmıştır. İnsanlarda bulunan HEV ile domuzlardan izole edilen HEV’in genotipik olarak %97’den fazla benzerlik göstermesi ve iki suşun da genotip III’e ait olması hastalığın zoonoz olduğuna dair kanıtlar olarak görülmektedir. Amerika’da domuzlarda HEV’in bulunmasından sonra Arjantin, Avustralya, Japonya, Kanada, Çin, İspanya, İsveç, Hindistan, İngiltere gibi gelişmiş ve gelişmekte olan ülkelerin çoğunda da domuzlardan HEV identifiye edilmiştir16. Domuzlardan başka diğer hayvan türlerinin de Hepatit E enfeksiyonundan etkilenebileceği ve bu hayvanların doğada HEV’in rezervuarı olabileceği düşünülmektedir. Bu hayvan türleri arasında at, sığır, koyun, keçi, geyik, köpek, deve, kedi, yaban domuzu, tavşanlar ve ratlar bulunmaktadır16,17,38.
Korunma
Her iki hastalığın da günümüzde spesifik bir tedavisi olmamasından ötürü korunma tedbirleri önem teşkil etmektedir. Korunma tedbirlerinin başında ise temiz su kaynaklarına erişim, kanalizasyon artıklarının içme ve kullanma sularına karışmasının engellenmesi, tarımda kullanılacak suların kanalizasyon artıklarıyla kontaminasyonunun engellenmesi, hastalıktan korunmada önemli yer teşkil etmektedir. Ayrıca Hepatit A enfeksiyonunun yaygın olduğu bölgelere seyahat edenlere aşı uygulaması, hijyenik koşullara dikkat etmeleri, çiğ ya da az pişmiş gıdaları, özellikle de deniz ürünlerini tüketmemeleri önerilmektedir10.
Hastalıktan korunma stratejileri arasında immünizasyon da yer almaktadır. İmmünizasyon aktif ve pasif olmak üzere iki şekilde gerçekleştirilmektedir. Pasif immünizasyonda Hepatit A enfeksiyonuna karşı immünite geliştirmiş kişilerden elde edilen immün serum globulin (ISG) kullanılmaktadır. Aktif immünizasyon için ise, günümüzde beş inaktif, bir attenüe ve bir kombine olmak üzere toplam 7 çeşit aşı geliştirilmiştir10.
Virüsün inaktivasyonu da korunmada başvurulacak yöntemler arasındadır. Hepatit A genel olarak otoklavlanarak (121°C’de 20 dakika), ultraviole radyasyonla (1.1 W 0.9 cm derinlikte 1 dakika veya 197 μW/cm2 4 dakika), formalinle (1:4000 37°C’de 72 saat, %3’de 25°C’de 5 dakika veya %8’lik solüsyonla 25°C’de 1 dakika), propiolakton ile (%0.03 4°C’de 72 saat), iyotla (3 mg/L 5 dakika), klor bazlı dezenfektanlarla (serbest klor miktarı 2.0 ile 2.5 mg/L ile 15 dakika veya sodyum hipoklorit ile 3-10 mg/L 20°C’de 5 ile 15 dakika) inaktive edilebilir. HAV %70’lik etanol ile 25°C’de 3 ve 60 dakika tutulursa sırasıyla, 2.5 ve 5.5 log’lık azalma sağlanabildiği belirtilmiştir. Ayrıca HAV 30 mg/L potasyum permanganat konsantrasyonunda 5 dakikada inaktive edilebilmektedir7,9,10.
Hepatit E esas olarak su kaynaklı epidemilere neden olmaktadır. Hastalığın endemik olduğu bölgelerde, korunma için alınacak önlemlerin başında temiz su kaynaklarına erişimin sağlanması ve su kaynaklarının atık sularla bulaşmasının engellenmesi gelmektedir. Salgınlar sırasında içme sularının kullanımdan önce kaynatılması hastalığın görülme riskini önemli oranda azaltmaktadır. Suların uygun şekilde klorlanması da salgınların görülme riskini azaltan önlemler arasındadır. Hepatit E enfeksiyonunda aktif bağışıklık için Çin’de bir adet ticari aşının mevcut olduğu belirtilmiştir39.
Gıdalarda ve Sularda Hepatit A ve Hepatit E’nin inaktivasyonu
HAV’ı gıdalarda elimine etmek için yapılan çalışmalarda, kıyılmış sebzelerde 4°C’de 9 günde 2 log azalma saptanmıştır. Ancak havuç ve rezene gibi sebzelerde HAV’ın daha uzun süre canlı kalabildiği tespit edilmiş bunun da muhtemelen partikül büyüklüğü ve sebzenin yapısından dolayı kaynaklanabileceği belirtilmiştir40. Ticari olarak hazırlanmış, marine edilen midyelerde 4°C’de 1.7 log’lık azalma ancak 4 hafta sonra sağlanabilmiştir41. Dondurulmuş ahududu, çay üzümü, çilek, maydanoz ve fesleğenle yapılan çalışmada HAV sayısının 90 gün boyunca sabit kaldığı ve dondurma yönteminin HAV’ı elimine etmekte uygun bir yöntem olmadığı saptanmıştır42. Asidifikasyon ile inaktivasyonda oda sıcaklığında pH 1’de 5 saat, 38°C’de 90 dakika tutulduğunda ise hala enfeksiyöz özelliğini koruyabildiği saptanmıştır43. Su aktivitesi düşürüldüğü zaman HAV’ın inaktivasyonu 20˚C’de por olmayan cansız yüzeylerde 4 saatte sağlanmış, %80 bağıl nemde ise, %25 bağıl neme oranla canlılığında daha fazla azalma olduğu saptanmıştır (44). Ancak başka bir çalışmada bağıl nem arttırıldığı zaman (%90), orta bağıl neme (%50) göre, 20°C’de 60 gün boyunca HAV’ın canlı kalma süresinin arttığı gözlenmiştir ve 60 günlük sürede 2 log düşme saptanmıştır45. Kurutma, virüsün canlı kalması üzerine önemli oranda etki etmektedir. Ancak HAV içeren fekal materyalin 25°C’de %42 bağıl nemde 30 gün boyunca kurutulduğunda dahi enfeksiyöz kalabildiği saptanmıştır46. Modifiye atmosfer paketlemede ise 4°C’de inkübe edilen sebzelerde, HAV’ın canlılığı üzerinde herhangi bir etkisinin olmadığı tespit edilmiştir47.
Sıcaklık, yüksek hidrostatik basınç, irradyasyon da gıdalarda virüsleri inaktive etmek için uygulanan koruma metotları arasında yer almaktadır. Sıcaklıkla HAV’ı inaktive etmek için steril yağsız süt (%0 yağ), homojenize edilmiş süt (%3.5 yağ) ve kremada (%18 yağ) 71°C’de 1 log azalma için sırasıyla 0.16, 0.18 ve 0.52 dakika gerekirken, aynı sıcaklıkta 4 log azalma sağlamak için 6.55, 8.31, 12.67 dakika gerektiği saptanmıştır48. Homojen hale getirilmiş midyelere 60°C’de 10 dakika ya da 80°C’de 3 dakika ısı işlemi uygulamanın 2 log azalma sağladığı, aynı sıcaklıklar hücre kültüründe kullanıldığında ise 4.6 log azalma sağladığı belirtilmektedir. Bu durum gıdanın yapısının virüsün inaktivasyonunda nasıl bir rol oynadığını göstermektedir49. Ayrıca ıspanakların 100°C’de 120-180 saniye haşlanmasıyla 6 log’dan fazla HAV’ın inaktive edilebildiği tespit edilmiştir50. Yeşil soğanlarda UV (240 mW s/cm2), ozon (6.25 ppm, 40 s 4°C), yüksek basınç (500 MPa, 2 dakika 20°C) ve klor (150 ppm 40 s 4°C) uygulandığında sırasıyla; 5.2 log, 2.0 log, 5.5 log ve 2.6 log HAV’ın inaktive edilebildiği belirtilmiştir51. Çileklerin kimyasal karakteristikleri taklit edilerek hazırlanan sentetik ortamda HAV’ın sıcaklığa karşı dayanıklılığı tespit edilmiş ve pH ile sükroz konsantrasyonunun virüsün inaktivasonunu etkilediği görülmüştür52. Yüksek hidrostatik basınç ile HAV’ın inaktivasyonu incelendiğinde 21°C’de 5 dakika 375 MPa’ya maruz bırakılmış ve püre haline getirilmiş çilek ve yeşil soğanda sırasıyla 4.3 ve 4.7 log azalma olduğu saptanmıştır. Ancak çalışmada kullanılan ürünlerde yapısal ve organoleptik olarak değişikliklerin meydana geldiği belirtilmiştir. Ultraviole ışık uygulamasında ise sebzelere 40 mWs/cm2 dozda UV ışık uygulanmış 4.3 log’lık azalma sağlanmıştır. Gamma irradyasyonla sebze ve çileklere HAV miktarını 1 log azaltmak için 3 kGy doz uygulanması gerektiği tespit edilmiştir. Midye ve istiridyelerde yapılan çalışmalarda 2.0 kGy dozun, HAV sayısını 1 log düşürdüğü tespit edilmiştir42,53,54. Klorinasyonda ise sebzeler, 5-10 dakika 20 ppm serbest klora maruz bırakıldığında HAV’ın ancak %90 oranında inaktive edildiği belirtilmiştir. 200 ppm serbest klor uygulanan çileklerde 0.5, 1 ve 3 dakikada sırasıyla 0.5, 0.6 ve 1.2 log azalma sağlanmıştır55.
HAV düşük pH ve yüksek sıcaklığa karşı bir miktar dirençlidir. 60°C’de 1 saat’te virülensini kaybetmemektedir. Oda sıcaklığında 4 hafta, suda ise 3-10 ay kaldığında enfektivitesinde 100 kat azalma olduğu görülmüştür. Gıdaları 85°C’de 1 dakika tutmak veya 1:100 sodyum hipokloritle yüzey dezenfeksiyonu yapmak HAV’ı inaktive etmektedir4. Sıcaklık HAV inaktivasyonunda en etkili yöntemlerden birisidir. Deniz kabuklularında, tamamen inaktivasyon için merkezi sıcaklığı 85-95°C olacak şekilde 1.5 dakika tutmak inaktivasyon için yeterli görülmektedir2,28. Süt ve süt ürünlerine uygulanan rutin pastörizasyon işleminin ise HAV’ı inaktive etmek için yeterli olmadığı bildirilmektedir28. Süte (%3.5 yağ) 65°C’de 6.2 dakika ısıl işlem uygulandığında HAV sayısında 1 log azalma olduğu, 5 log azalma için ise 85°C’de 0.5 dakika tutulması gerektiği belirtilmektedir28. HAV’ın basınçla inaktivasyonunda pH ve artan tuz oranının basınca karşı koruyucu etki gösterdiği ve virüsün dayanıklılığını arttırdığı, pH düşürüldüğü ve sıcaklık yükseltildiği zaman ise basıncın inaktivasyon etkisinin arttığı tespit edilmiştir56.
Sularda HAV’ın inaktivasyonunda 5 mg/L klor dioksite 60 dakika maruz bırakıldığında virüs sayısında 3.99 log azalma olduğu belirtilmiştir57. Ayrıca HAV’ın 10 dakika 5, 10 ve 20 mg klora maruz bırakıldığında ise sırasıyla; %24.2, %94.38 ve %98.93 oranında inaktive edilebildiği belirtilmiştir58. Türkiye’de ise ‘‘İnsani Tüketim Amaçlı Sular Hakkında Yönetmelikte’’ suların klorla dezenfeksiyonunda 0.2-0.5 mg/L’e izin verilmektedir59. Klorinasyon dışındaki yöntemlerde ise UV irradyasyonla 4 log HAV inaktivasyonu için 16 mW saniye/cm2 gerektiği, ozonla inaktivasyonda ise 20°C’de 0.25-0.38 mg/L dozun HAV’ı tamamen inaktive ettiği belirtilmektedir60.
HEV’in gıdalarda inaktivasyonu için yeterli bilgiler olmamasına rağmen etkenin HAV’dan daha az stabil olduğu bildirilmektedir61. Viral partikülün son derece istikrarsız olduğu, virüsün dış katmanını, 4°C’de birkaç günlük saklama, dondurma-çözdürme, yüksek tuz konsantrasyonuna maruz kalma durumunda kaybetme eğiliminde olduğu bildirilmektedir. HEV’in termal stabilitesi incelendiğinde etkenin 56°C’de inaktive edilemediği, 60°C’de ise %80 oranında inaktive edildiği bildirilmektedir61.