Kanser, hücrelerin aşırı ve zamansız çoğalmalarına yol açan metabolik ve davranışsal değişiklikler geçirdikleri, çok basamaklı bir süreçtir. Bu değişiklikler hücre çoğalmasını ve ömrünü, komşu hücrelerle ilişkileri ve immun sistemden kaçma kapasitesini kontrol eden mekanizmaların modifikasyonları sonucu ortaya çıkar. Kanserli hücrenin gelişmesi için üç ana kural ihlal edilmelidir. Bu kurallardan ilki, hücrelerin sadece uygun sinyal ile bölünmeleridir. Bu kuralın ihlali, hücrelerin bir hormon ya da büyüme faktörü ile uyarıldığında normal olarak aktif hale geçen devrelerin, bir daha kapanmamasıyla olmaktadır. Bir diğer kural, hücrelerin anormal koşullarla karşılaştığında, hasarlı olan genlerin DNA replikasyonunu başlatmak yerine apoptozisi aktif hale getirmeleridir. Apoptozisden kaçmak için hücrelerin normalde aşırı hücre bölünmesini engelleyen mekanizmaları önlemesi gerekmektedir. Bu mekanizmalar iki önemli gen tarafından düzenlenmektedir. Bu genler Retinoblastoma ve TP53 genleridir. Bu iki mekanizma mutasyonla etkisiz hale geldiğinde hücreler sadece bölünmez, bununla birlikte apoptozisten de kaçarlar ve böylece tümöral doku oluşumu başlamaktadır. Sonuncusu ise normal hücrelerin sınırlı bölünmesiyle ilgilidir. Normal hücreler kromozomların ucunda bulunan telomerler nedeniyle belirlenmiş sayıda bölünmektedir. Telomerler, bölünmeyle uzaklaşan DNA tekrarlarından oluşur. Tekrarlar bittiğinde hücre bölünme özelliğini yitirmiş yaşlı hücre halini alır. Kanserli hücrede telomeraz enzimi kromozoma yeni tekrarlar ekleyerek bölünme özelliğinin ortadan kalkmamasını sağlar ve hücre programlandığından çok daha uzun bir süre boyunca bölünür
1,2.
2. GLİKOLİZİS
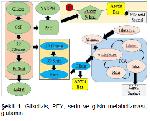
Dinlenme safhasındaki normal hücrelerin metabolik programları, homeostatik dengelerini ATP üretimi ile karşılamaya yöneliktir. Buna karşın prolifere olan hücreler sadece hücre replikasyonu için yeterli enerjiyi üretmemeli, bununla birlikte makro moleküllerin biyosentez ihtiyacını karşılamalı ve reaktif oksijen türlerinin (ROS) üretimine cevap olarak hücresel redoks dengesini korumalıdır. Tümör hücrelerinin büyümesi ve devamlılığı metabolik çözümlere önemli ölçüde bağlıdır. Bu proliferatif çözümler primer olarak glikoz ve glutaminden sağlanır3-6. Kanser hücresi, büyüme ve proliferasyon ihtiyaçlarını karşılayabilmek için hücresel metabolizmayı yeniden düzenlemek zorundadır. Çoğu metabolik değişiklik, büyük ölçüde normal prolifere olan hücrelerle aynı olmasına rağmen, kanser hücrelerinde genetik lezyonlar ve tümör mikro çevresi gibi genetik olmayan faktörlerin kombinasyonu sonucu, anormal şekilde artar3,5. Kanser hücrelerinin atipik metabolik özellik gösterebilecekleri, Otto Warburgun 20. Yüzyılın ilk yarılarında yaptığı öncü çalışmalar sonucu anlaşılmıştır3,7. Normal hücreler oksijen varlığında glikozu, pirüvata glikolizis yoluyla parçalar ve daha sonra oluşan pirüvatın büyük çoğunluğunu oksidatif fosforilasyon yoluyla mitokondride tamamen okside edip CO2e dönüştürür. Anaerobik koşullarda ise, normal hücreler glikolitik pirüvatı mitokondrial oksidasyona yönlendirmeyip, onun yerine büyük ölçüde laktata indirger8. Warburgun çalışmasından köken alan temel paradigma normal hücrelerin aksine, hızlı prolifere olan tümörlerin, bu işlem sonucu üretilen 1 molekül glikozdan elde edilen ATP miktarının çok az olmasına rağmen glikozu aerobik ortamda laktata dönüştürmesidir (Şekil 1). Görünürde mantığa aykırı gelen bu fenomen, "WARBURG ETKİSİ" ya da "AEROBİK GLİKOLİZİS" olarak adlandırılır3,8. Tümör hücrelerinde bulunan çoğu metabolik yolak arasında anahtar rolü, bahsi geçen Warburg Etkisi oynar9. Kanser hücrelerinin bu görünürde zarar verici davranışları aslında, prolifere olan hücrelerin geçici veya kalıcı hipoksik şartlara duyarsız olmalarını sağladığından hayatta kalma avantajı oluşturmaktadır. Ayrıca kanser dokularında meydana gelen artmış glikoz alımı sayesinde nükleozidlerin ve aminoasitlerin üretimine katkıda bulunmakta ve enerji üretimi için çok hızlı bir yol oluşturmaktadır9,10. Dahası laktat bu süreçte sadece atık ürün değil, aksine hücre göçünü, yeni damar ağlanmasını, immun sistemden kaçışı ve radyoaktif direnci geliştirerek tümör invazyonunu arttıran bir ajan olarak rol oynamaktadır10,11. Glikoz katabolizması, değişmiş kanser metabolizmasına atfedilmiş belirleyici marker olmasına rağmen, bu metabolizmadaki değişikliğin tek başına hücre büyümesinin metabolik ihtiyaçlarını karşıladığı söylenemez. Son yıllarda glutaminin, proliferasyonda önemli ölçüde enerji sağlayan kritik besin olduğu anlaşılmıştır. Glikoz ve glutaminin tümorogenezis sırasında nasıl ağlanma yaptığıyla ilgili çalışmalar kanser tedavisinin, bu belirteçlere yapılacak müdahaleyle mümkün olabileceği konusunda iyimser bir tavır doğurmuştur. Buna rağmen, normal prolifere olan hücreler de aynı metabolik ihtiyaçları ve adaptasyonları kullandığından, hedef tümör teropatik bakış açısının kurulmasının zor olduğu söylenebilir.
Çoğu proliferatif hücre, glikozu daha fazla getirisi olan ve dinlenme aşamasında olan hücrelerin kullandığı oksidatif fosforilasyon yerine, aerobik glikolizis (Warburg Etkisi) ile metabolize etmektedir4. Başlangıçtaki yanılgı, prolifere olan hücrelerin mitokondrial bozukluklara sahip olduğu ve bu yüzden fermantatif glikoz metabolizmasını enerji ihtiyaçlarını karşılamak için kullandıkları yönündeydi. Buna rağmen, mitokondrial solunumun çoğu prolifere olan hücrede devam ettiği ve sonuçta primer ATP kaynağı olarak rolünü sürdürdüğü gösterilmiştir3,8,12. Bunun aksine, glikozun artan alımı ve tercihi katabolizmasının laktat yönünde olmasının biyokütle birikimini desteklemeye ve prolifere olan hücrelerde redoks dengenin korunmasına yönelik olduğu ileri sürülmüştür3,10.
Glikoz metabolizmasının bu şekilde yönlendirilmesi, glikozun spesifik membran (GLUTs) ve laktat taşıyıcıları (MCTs) ile glikolitik yolağın çoğu efektörünün aşırı ekspresyonuyla, aynı zamanda glikozun laktata dönüşmesinde görev alan sorumlu enzimlerin de artışı ile sağlanmaktadır9.
2.1. Glikoz taşıyıcıları (GLUTs)
GLUTs, hidrofobik hücre membranları üzerinden glikozun transportunu düzenleyen protein ailesini oluşturmaktadır. Bugüne kadar, aynı yapısal özellikleri gösteren fakat farklı hücresel yerleşimli ve kinetik özellikli, glikoz ile diğer heksozlara farklı affiniteli GLUT genlerinin 14 izoformu tanımlanmıştır9. Farklı GLUTların, kanser tiplerinin büyük bir kısmında aşırı eksprese olduğu ve bu ekspresyon düzeylerinin sıklıkla tümörün metastazik potansiyeli ve kötü prognozu ile ilişkili olduğu ortaya konmuştur13.
2.2. Hekzokinaz (HK)
Glikolizisin ilk basamağı hekzokinaz tarafından katalizlenmekte ve glikoz-6-fosfat ile sonuçlanan glikoza ATPden elde edilen bir fosfat grubunun transferini içermektedir. Hekzokinazın izoformu HK2nin, tümör hücrelerinin glikolitik metabolizmasını yeniden düzenlemede iki önemli rol oynadığı düşünülmektedir. İlki, HK2nin artışının glikolizis oranlarındaki artış ile sonuçlanmasıdır. Diğer rolü ise HK2nin bir kompleks içerisinde dış mitokondrial membran üzerindeki, voltaj bağımlı anyon kanalları ile ilişkisiyle mitokondriden sitokrom c salınmasını engelleyerek apoptozisin inhibe edilmesine katkıda bulunmasıdır9. Dahası, mitokondriye bağlı HK2 ürün inhibisyonuna duyarsızdır ve böylece glikozun fosforilasyonu için yeni sentezlenen ATPye tercihi erişim kazanır14.
2.3. Fosfofruktokinaz (PFK)
Fosfofruktokinaz 1 (PFK1), glikolizisin en kritik basamaklarından biri olan fruktoz-6-fosfat ve ATPnin fruktoz-1,6- bifosfat ve ADPye dönüşümünü katalizlemektedir. PFK1 aktivitesi, üretimi fosfofruktokinaz 2 tarafından düzenlenen allosterik aktivatörü olan fruktoz-2,6-bifosfat tarafından arttırılmaktadır. Fosfofruktokinaz 2nin, kinaz ve fosfataz olarak ikili fonksiyonu olduğundan fruktoz-2,6-bifosfataz (PFK2/FBPase) olarak da isimlendirilmektedir9. PFK2/FBPaz ailesine ait 4 izoenzim arasından PFKFB3, HIF1α düzenlemesi altındaki hipoksik tümörlerde aşırı eksprese olmakta ve kinaz aktivitesindeki artış sayesinde, bu tümörlerde glikolitik aktivitedeki artışa katkıda bulunmaktadır10,15.
2.4. Fosfogliserat Mutaz (PGM)
Fosfogliserat mutaz (PGM), 3-fosfogliseratın 2-fosfogliserata geri dönüşümlü değişimini katalizlemektedir. Memelilerde, iki kas (PGM-MM), iki beyin (PGM-BB) monomeri içeren iki homodimer ya da heterodimer olarak (PGM-MB) bulunmaktadır. Homodimerlerden bir tanesi, PGM-BB insanlarda PGM1 olarak da isimlendirilmektedir. PGM1in genellikle insan kanser dokularında regülasyonunun arttığı fakat kanser hücre metabolizmasındaki rolünün tam olarak bilinmediği rapor edilmiştir9.
2.5. Enolaz
Enolaz, 2-fosfogliseratın 2-fosfoenolpiruvata dönüştürülmesinden sorumlu glikolitik enzimdir. α-enolaz izoformun (ENO1) artmış ekspresiyonu çoğu tümörde tespit edilmiş ve son zamanlarda Muller ve ark. Enolazı anti-kanser hedef olarak tayin etmişlerdir9.
2.6. Pirüvat Kinaz (PK)
Piruvat kinaz (PK), piruvat ve ATP sentezi için fosfat grubunun fosfoenolpiruvattan ADPye transferini içeren glikolizisin final hız sınırlayıcı basamağını katalizler. PKM2 izoformu yüksek aktiviteli tetramerik ve düşük aktiviteli dimerik formda bulunabilir. Dahası, glikolitik ara ürün fruktoz-1,6-bifosfat ve doğal aminoasit olan serin PKM2nin allosterik aktivitörleridir. Az aktif olan PKM2nin dimerik formu glikolizis oranlarında bir düşüşe neden olur ve çoğu tümör hücresinde PKM2nin düzenlenmesinde artış olduğu gözlemlenmiştir. Bu durum tümör hücrelerindeki laktat üretim oranına bakılarak paradoks olarak görülebilmektedir, fakat dimerik PKM2, kendi reaksiyonu üstündeki bütün glikolitik ara ürünlerin birikmesine neden olabilmekte, böylece sentetik anabolik süreç aynı zamanda enerji üretimi için metabolik öncüleri ulaşılabilir kılmaktadır9,16.
2.7. Laktat Dehidrogenaz (LDH)
Piruvatın laktata reversibl dönüşümünü eşzamanlı olarak kofaktör NADnin NAD+ye oksidasyonu ile katalizleyen en önemli glikolitik hedeflerden biri laktat dehidrogenaz (LDH) enzimidir. İnsan izoformu LDH-A ya da LDH5 dört A alt ünitesinden (LDH-A4) oluşmakta ve en fazla karaciğer ile kas dokusunda eksprese olmaktadır. Literatürdeki bulgular, invazif glikolitik kanserlerde aşırı regüle olan LDH-Anın hücre proliferasyonunda önemli rol oynadığını, düşük oksijen konsantrasyonlu ortamlarda dahi tümörün hayatta kalmasını sağladığını göstermektedir9.
Glikolizis, tek bir glikozun alımı ve onun çok basamaklı bir süreç sonunda tek bir sonuca (piruvata) dönüştürüldüğü metabolik bir sonuç değil, aksine glikolizis karbon metabolizmasının önemli bir yoludur, özellikle hücresel yapıtaşlarının "de novo sentezi" ile ilişkilidir. Çeşitli glikolitik ara ürünlerinin substrat olarak görev yaptığı diğer birçok metabolik yolakla bağlantılıdır17. Yüksek glikoz alımında glikolitik yolakta dallanmış biyosentetik ara yollara glikolitik metabolitlerin akışı önemli ölçüde artmaktadır. Örneğin; fruktoz-6-fosfat ve gliseraldehit-3-fosfat, nükleotid biyosentezinde kritik ara ürün olan riboz-5-fosfat (R5P) ile sonuçlanan pentoz fosfat yolunun (PFY) non oksidatif koluna taşınmış olabilir3.
3. PENTOZ FOSFAT YOLAĞI
Heksoz monofosfat şantı ya da fosfoglukonat yolu olarak da bilinen PFY, hekzokinaz tarafından katalizlenen birincil substrat olarak glikoz-6-fosfatı (G6P) tüketen glikolizisin ilk basamağından dallanmaktadır (17). Eritrositlerde, PFY büyük bir ROS temizleyicisi olan indirgenmiş GSHın üretimi için gerekli olan NADPHın önemli bir kaynağıdır (Şekil 1). Bu yüzden zayıflatılmış PFY aktivitesi, eritrositleri PFY ile ilişkili olan oksidan ve ürünlere daha yatkın hale getirmektedir18. Otto Warburg, 1930larda PFYnin ilk basamağı olan glikoz-6-fosfatın oksidasyonu için NADP+nin gerekli olduğunu keşfetmiştir. Ardından Frank Dickens ve arkadaşları 1950lerde PFY yolağını tamamen aydınlatmıştır. Bu çalışmalar birlikte değerlendirildiğinde, temel fonksiyon olan fosfopentozların ve ribonükleotidlerin üretimine ek olarak, PFY yolağının NADPHın temel kaynağı olduğu ve hücresel redoks dengede esas rol oynadığı görülmüştür (Şekil 1). PFY iki faz veya kol içerir; Oksidatif kol ve nonoksidatif kol. NADPH ve ribonükleotid üreten oksidatif kol 3 geri dönüşümsüz reaksiyona sahiptir. İlk reaksiyonda G6P, G6PDH tarafından NADPH ve daha sonra 6-fosfoglukonolaktanaz (6PGL) tarafından 6- fosfoglukanata hidrolize olan 6-fosfoglukanolaktona dehidrojene edilmektedir. Üçüncü reaksiyon 6-fosfoglukonat dehidrogenaz tarafından 6-fosfoglukonatın ikinci bir NADPH ve daha sonra riboz-5-fosfata dönüştürülen ribuloz-5-fosfat (Ru5P) oluşturmak için oksidatif dekarboksilasyondur. Non-oksidatif kol fruktoz-6-fosfat (F6P) ve gliseraldehit-3-fosfat (G3P) gibi pentoz fosfatlara ve daha sonra tersine dönüşebilen ek glikolitik ara ürünlerin alındığı geriye dönüşümlü reaksiyonlar serisinden oluşmaktadır17.
Hızlı bölünen hücrelerde DNA ile ilişkili olan Pentoz Fosfatların çoğu PFYden köken almaktadır. Böylece PFY hem oksidatif koldaki G6P hem de nonoksidatif koldaki F6P ve G3Pnin üretimine doğru aktarılır. Bu yüzden PFYnin farklı modları glikozun glikolizisteki akışını ve tersini etkileyebilmektedir (Şekil 1). PFY özellikle kanser hücreleri için önemlidir. Çünkü PFY yalnızca kanser hücrelerinin yüksek oranda nükleik asit sentezini karşılamak için pentoz fosfatları üretmez, bunun yanında hem yağ asitleri sentezi için hem de stres koşulları altında hücrelerin hayatta kalması için gerekli olan NADPHı temin eder. R5P ve NADPH üretimi oksidatif strese karşı hücresel savunmaya katkıda bulunmaktadır17.
4. SERİN VE GLİSİN METABOLİZMASI
Pirüvatın alt yolak sonuçlarından biri alanine transamine olmasıyken, glikolitik ara ürün 3-fosfogliserat (3PG) serin biyosentez yolağı akışı üzerinden birçok esansiyel olmayan amino asite karbon iskeleti sağlamaktadır. Dahası, 3PG-kökenli serin fosfolipid sentezini besleyebilmesine rağmen, dihidroksiaseton fosfatın 3-fosfogliserata indirgenmesi etkin bir biçimde hücrelere fosfolipid ve triaçilgliserol biyosentezinde kritik bir substrat sağlamaktadır (Şekil 1). Glikolizisin alt yolağındaki glikoz kökenli pirüvat TCA siklusuna girer ve stoplazmaya taşınması ile "de novo yağ asidi sentezini" besleyen mitokondriyel sitratın üretimine katkıda bulunmaktadır6. Kanser hücreleri hücre büyümesini ve proliferasyonunu sağlamak için çok özel metabolik yeniden düzenlemeler yapmaktadır8. Aşırı enerji ihtiyacının yanında kanser hücreleri nükleik asitler, proteinler ve lipitlerin aynı zamanda hücresel redoks düzeyinin korunması için önemli kofaktörlerin içerisinde olduğu yeni hücresel bileşenlerin yapımı için yapı taşlarını biriktirmektedir9. Glikoz ve glutamin glikolizis ve trikarboksilik asit döngüsünün (TCA) anaplerotik akışı gibi aktif esansiyel akışı korumada kullanılan iki ana kaynaktır. Anabolik yolaklarda serin biyosentetik yolu glikoz dönüşümünde önemli bir dönüm noktası teşkil etmektedir19. Taşınan serin ve glikolizisin bir dalından köken alan serin, tek karbon metabolizması için karbon ünitelerini temin eden glisine dönüştürülebilmektedir. Proteinlerin, lipidlerin, nükleik asitlerin ve diğer kofaktörlerin sentezi folat bileşenlerinin kimyasal reaksiyonları üzerine kurulu olan karmaşık metabolik ağlanma olan tek karbon metabolizmasını gerektirir. Tek karbon metabolizması diğer metabolik yolaklara transfer olduğu periyodik yolaklara doğru yol almaktadır. Bu metabolik yolakların önemi son zamanlarda antifolat kemoterapisinin kanser tedavisinde yaygın olarak kullanılmasıyla belirlenmiştir. Serin ve glisin; protein, nükleik asit ve lipitler için öncü molekülleri temin etmektedir. Bununla birlikte, serin biyosentezinin düzenlenmesi antioksidan kapasiteyi direkt kontrol etmekte, bu yüzden tümör homeostazın korunmasında etki göstermektedir20.
De novo serin biyosentezi, glikolizis, çoğu hücre türünde ATP ve enerji sağlar, fakat kanser hücreleri tümör gelişiminde önemli olan glikolizisi anabolizmayı sürdürmek için aşırı derecede kullanmaktadır. Serin biyosentezi bu glikolizis aktarılmış yolaklardan biridir. Glikolitik ara ürün 3-fosfogliserat üç basamaklı enzimatik reaksiyonun sonunda serine dönüştürülmektedir20. Kanser hücreleri, glikolizisten köken alan 3-fosfogliseratın yaklaşık %10unu serin öncüsü 3-fosfohidroksipiruvata dönüştürmek için fosfogliserat dehidrogenaz (PHGDH) enzimini kullanır21. Yolaktaki sonraki enzimler 3-fosfohidroksipiruvatı serine transaminasyon (PSAT1) ve fosfat ester hidrolizi (PSPH) reaksiyonuyla dönüştürür. Serin biyosentetik reaksiyonlar için önemli bir metabolittir, fakat PHGDH baskılanması dış kaynaklı serin içeren vasatta kültüre edilmiş hücrelerde dahi proliferasyonu inhibe etmektedir20. Hücre içi serin düzeylerinin kontrolünün yanında serin biyosentez aktivitesinin ek sonuç ve çıktıları, kanserde PHGDHnin aşırı regülasyonunun gerekliliğine değinmektedir22. Örneğin; PSAT1 PHGDHnin ürünü olan 3-fosfohidroksipirüvatı kullanarak glutamatı α-ketoglutarata dönüştürmektedir. α-ketoglutarat, TCA döngüsünü yeniden besleyen ve kanser metabolizmasının devamlılığını sağlayan anaplerotik ara ürünlerden bir tanesidir. Bu yolaklar üzerinden serin sentez yolu, TCA ara ürünlerinin büyük bir iştirakçisidir ve TCA döngüsünün anaplerotik akışının yaklaşık yarısından sorumludur. "De novo serin sentezi" çoğu biyosentetik yol için öncüdür ve buna göre, "de novo serin sentezinin" en önemli yönlerinden biri de serinin, serin hidroksimetiltransferaz (SHMT) enzimiyle glisine dönüştürülmesidir. Daha önce de belirtildiği gibi glisin, glutatyonun (GSH), proteinlerin, pürinlerin ve DNA/histon metilasyonunun biyosentezi için gerekli tek karbon havuzunun en önemli kaynaklarındandır20.
5. GLUTAMİN
Glutaminin diğer amino asitlerle karşılaştırıldığında prolifere olan hücrelerin metabolizmasında benzersiz bir rol oynadığı uzun zamandır bilinmektedir23,24. Glutamin insan serumunda en fazla bulunan aminoasittir3. Yine plazmada en fazla bulunan amino asittir ve çoğu tümör hücresi glutamini diğer amino asitlere oranla çok daha yüksek oranlarda tüketmektedir23. Glutamin normal ve bölünmeyen dokular için non esansiyel bir amino asit olmasına rağmen, çoğu hücrenin çoğalması ve glutamine bağımlı olan bazı kanser hücrelerinin canlılığı için esansiyeldir25. Glutamin metabolizması, kanser hücrelerinin devamlı büyüme ve prolifere olma yeteneğine ATP üretimini, protein, lipit ve nükleik asit biyosentezini destekleyerek katkıda bulunmaktadır. Glutamin aynı zamanda redoks homeostazı düzenlemekte ve sinyal iletim yolağı aktivitesi üzerine etki göstermektedir. Glutamin, enerji üretimi için karbon kaynağı olarak görev yapmakta, biyosentetik reaksiyonlara karbon, nitrojen katkısında bulunmakta ve redoks homeostazı düzenlemektedir26.
Prolifere olmayan hücreler, kendi enerji ihtiyaçlarını karşılamak için glikoz kökenli karbonları TCA siklusunda tamamen okside etmekteyken, prolifere olan hücreler ATP üretimine ek olarak besinleri biyosentezi desteklemek için kullanmaktadır. Sitrat üretimine katkı yaparak glutamin "de novo lipogenezisi" destekler27. Prolifere olan hücrelerde sitrat, stoplazmada lipit biyosentezinde prekürsör olan asetil CoAnın oluşturulmasında kullanılmak üzere mitokondri dışına gönderilmektedir (Şekil 1). TCA döngüsünde devam eden sitrat kaybından dolayı TCA ara ürünlerinin yenilenmesi (anaplerozis) önemlidir ve glutamin çoğu prolifere olan hücrede önemli bir anaplerotik substrattır16,26,28. Sitrat, Asetil CoA ve okzalasetatın kondenzasyonundan meydana gelmektedir. Glikoz ile glutaminin prolifere olan glioblastoma hücrelerinde 13C etiketlenmesi, bu hücrelerde okzaloasetatın en büyük kaynağının glutamin olduğunu, glikoz karbonlarının ise Asetil CoAnın önemli bir kaynağı olduğunu ortaya koymuştur27. Glutaminin TCA döngüsü fonksiyonlarını destekleyen karbon kaynağı olarak rolü glutamin bağımlı kanser hücreleri için kritiktir. c-Myci onkojenik düzeylerde eksprese eden hücreler glutamin tükenmesinde ölürler ve canlılık piruvat, okzalasetat ya da α-ketoglutarat gibi TCA siklusu ara ürünlerinin temini ile restore edilebilir29.
Bazı tümör türlerinde TCA döngüsü enzimlerinden Süksinat dehidrojenazı ve fumarat hidratazı kodlayan genlerdeki mutasyonlar sonucu enzimler inaktive olmakta, mitokondride süksinat fumarat metabolitleri artmaktadır. Bu metabolitlerdeki artışlar α-ketoglutarat bağımlı prolil hidroksilaz ailesinin aktivitesini bozar. Böylece Hipoksi indükleyen faktör 1αnın yıkımlanması önlemekte, hipoksik yanıt ile glikoliziste artışa neden olmaktadır30,31. Bu yüzden glutaminin lipit sentezi ve proliferasyonu desteklemesi, büyük ölçüde tümör mikroçevresindeki besinlerin ulaşılabilirliğini sağlaması ve sitrik asit döngüsünde anaplerotik substrat olarak rol oynamasıyla ilişkilidir26,31.
6. SONUÇ
Kanserin tedavisi zor bir hastalık olarak karşımıza çıkmasında, kanser hücrelerinin tek bir metabolik yol kullanmadığı, farklı mekanizmalar üzerinden hayatta kalmayı ve prolifere olmayı sağladığı bu derleme ile ortaya konmaya çalışılmıştır. Kanser hücrelerinin metabolik özelliklerini ve değişkenliğini açıklamaya yönelik çalışmalar, yeni tedavi hedeflerinin ortaya konmasını ve tümör hücre ölümünü gerçekleştirebilmek için en önemli hedef olan metabolik yollar üzerine doğru müdahalenin açığa çıkarılmasını sağlayabilecektir.