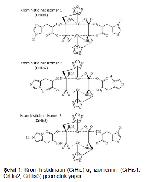
Yüksek yağlı diyet insülin direncine yol açarak obezite, metabolik sendrom ve diyabet gibi bir çok durumun patogenezinde rol oynamaktadır
2,34. Ancak, son yıllarda Cr gibi bazı iz elementlerin obezite ve diyabet gibi kronik problemlerin gelişmesine karşı koruyucu veya olumsuz etkilerini azaltma ile ilgili pek çok çalışma yapılmaktadır
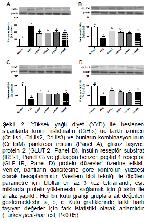
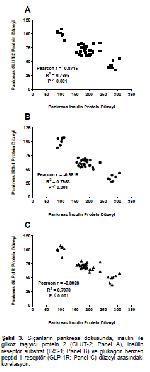
28,35-37. Bundan dolayı, bu çalışmada YYD ile insülin direnci indüklenen sıçanlarda, üç farklı CrHis izomerinin ayrı ayrı ve birlikte kullanımının pankreas insülin, GLUT-2, IRS-1 ve GLP-1R protein düzeyleri üzerine etkileri araştırılmış ve YYD ile beslenen sıçanlarda pankreas insülin düzeyi önemli bir biçimde yükselmiştir. Bu bulgulara benzer olarak, daha önce yapılan pek çalışmada da sıçanlarda YYD uygulamasının insülin direnci, oksidatif stres ve pankreas islet hücrelerinde hipertrofi ile hiperplaziye neden olduğu bildirilmektedir
6,38. İnsülin direnci durumunda, artan insülin salgısı ile istenilen insülin etkisi oluşturulamadığından organizma tarafından insüline ihtiyaç duyulduğu ve insülin yapımının uyarıldığı düşünülmektedir. Bu durum hiperglisemi ve hiperinsülinemi durumunu oluşturmaktadır
4,6. YYD ile beslenme sonucunda yükselmiş SYA'ların, glikoz ile uyarılmış β-hücre proliferasyonunu inhibe ettiği, bu durumun dislipidemi ve hiperglisemi kombinasyonunun azalmış bir β-hücre replikasyon cevabına neden olacağı düşünülmektedir
4. SYA ile insülin direnci ve obezite arasında bir ilişki olduğu bildirilmiştir
6,12.
Bu çalışmada, CrHis izomerleri ve kombinasyonları YYD ile beslenen sıçanların pankreas GLUT-2 protein düzeylerini artırmıştır. Artan GLUT-2 düzeyi ile hücre içine glikoz taşınmasının artırılarak hücre proliferasyonu ve insülin sekresyonunun düzenlenmesine yardımcı olduğu düşünülmektedir. Bu bulguları destekler nitelikte olan bir çalışmada, YYD ile beslenen sıçanlarda pankreatik GLUT2 düzeyinin, stres kaynaklı veya östradiol seviyelerine müdahale edilerek düşürüldüğü, GLUT2 protein seviyesinin düşüklüğüne bağlı olarak insülin üretiminde kısmi bir azalma olduğu bildirilmektedir 39. Pankreas β-hücrelerinde, GLUT-2 proteinleri aracılığıyla glikoz hücre içine alınmakta, glikoliz ile ATP/ADP oranı artmakta ve ATP K+ kanalı inhibe edilmektedir. Membran depolarizasyonu nedeniyle voltaj bağımlı Ca2+ kanalları açılarak, hücreye Ca girişi artar ve insülin salınımı düzenlenir 40. Organik krom formları olan Cr glisinat ve Cr asetat uygulanan YYD ile beslenen sıçanlarda, beyin dokusunda GLUT protein düzeyleri regüle edilerek ve glikoz homeostazisi düzenlenerek insülin direncinin olumsuz etkilerinin azaltılabileceği bildirilmiştir 26.
Bu çalışmada, YYD ile beslenen sıçanlarda benzer şekilde insülin seviyesi artarken, pankreas IRS-1 protein düzeyi kontrol grubuna göre düşük bulunmuştur. Uygulanan CrHis izomerleri ve kombinasyonu pankreas insülin ve IRS-1 değerlerinde bir iyileşme göstermiştir. Bu parametrelerin regüle edilmesinin insülin salınımı ve sinyalizasyonunda artışa neden olarak, insülin direncine karşı kısmi bir koruma sağlayacağı düşünülmektedir.
Çünkü insülin hormonu, hedef hücrelerde insülin reseptörüne bağlanarak, insülin reseptör tirozin kinaz alanını aktive ederek IRSnin fosforilasyonunu sağlar 6,13,41. Fosforlanmış IRS proteinleri ise PI3K ve daha sonra AKT (protein kinaz B) sinyal yolaklarını aktive ederek hücrelerin proliferasyon ve apoptozisinin düzenlenmesinde, ayrıca glikojen sentezinde aktif rol oynamaktadır 6,42. Ayrıca, YYD uygulamaları, reseptör yetmezliği olmaksızın toplam insülin reseptör sayısının azalmasına, IRS-1, PI3K ve Akt fosforilasyonu ve aktivitesini azalmasına ve hedef dokularda insülin etkinliğinin değiştirilmesi ile insülin direncine neden olarak diyabet oluşumunu indükleyebilirler 4,5,43. Nitekim, bu çalışmada elde edilen bulguları destekler nitelikte, YYD ile beslenen hayvanlarda hem insülin reseptörünün hem de IRS'larının azaldığı ortaya konmuştur 4,41. Ayrıca, Liu ve ark. 3, YYD ile insülin direnci indüklenen sıçanlarda, vaspin uygulaması ile IRS/PI3K/Akt/GLUT sinyal yolaklarının aktivasyonu ve IκBα/NF-κB gibi inflamatuar sinyal yolaklarının inhibisyonunun gerçekleştiğini ve bu etkinin metabolik sendrom, diyabet, hipertansiyon ve ateroskleroz gibi durumların patogenezinde etkili insülin direncinin azaltılması anlamına geldiğini bildirmişlerdir 3.
İnsülin sinyal iletimi, sadece pankreas β-hücrelerindeki sinyalleşmeyi etkilemekle kalmaz, aynı zamanda insülinin, α-hücrelerden gelen glukagon sekresyonunu IRS-1-PI3K yolu ile negatif yönde düzenlediği için insülin direnci artmış glukagon sekresyonuna da yol açabilir. Bu değişiklikler, hem insülin direncinin hem de artmış glukagon sekresyonunun, diyabet gelişimi ile ilişkili olduğunu düşündürmektedir 4,43.
Sreejayan ve ark. 17 obez farelerde yaptıkları bir çalışmada, Cr uygulaması ile insülin direncinin ve hücresel stresin azaldığı tespit edilmiştir. Benzer şekilde, obez sıçanlarda krom pikolinat uygulamasının insülin duyarlılığını artırdığı, karbonhidrat ve lipit metabolizmasını düzenlediği bildirilmektedir 35. Sıçanlarda CrHis ve biyotin uygulamasının glikoz ve insülin homeostazı ile lipit profili düzenlediği, IRS-1 ekspresyonunu regüle ettiği bildirilmektedir 44. Pankreas hücrelerinde insülin reseptörlerinin uyarılması ile IRS proteinlerinin insülin ve IGF-1 sinyalizasyonunun regülasyonu ile islet hücrelerinin büyümesi ve insülin sekresyonunun düzenlendiği gösterilmiştir 45. Bu durumun insülin reseptör sayısının azalması ve insülin direnci oluşması ile ilişkili olduğu bildirilmiştir 4,5 45.
Bağırsak L hücrelerinden salgılanan GLP-1, pankreas β hücrelerinde bulunan GLP-1R ile bağlanarak, pankreasta insülin salınımının düzenlenmesinde, apoptozun inhibe edilmesinde, proliferasyon ve neogenezin teşvik edilmesinde görev almaktadır 15,16,46. Ayrıca, GLP-1 insülin sekresyonunu arttırarak, glukagon sekresyonunu azaltarak ve gastrik boşalmayı geciktirerek diyabetin olumsuz etkilerinin azaltılmasında etkili bir faktör olarak da görülmektedir. Diyabet tedavisinde, GLP-1 agonistleri GLP-1Rne bağlanarak aktive eder ve diyabet tedavisinde kullanılabilir 15,16. Bu çalışmada YYD ile beslenen sıçanların pankreas GLP-1R düzeylerinde kontrol grubuna göre anlamlı bir azalma olmuştur. Sıçanlara CrHis izomerleri ve kombinasyonlarının uygulanması pankreas hücrelerinde GLP-1R düzeyinin artışını sağlamıştır. Bu durum insülin reseptör etkinliğinin artışı, hiperglisemi durumunun azalışı ve insülin direncinin azaltılması ile ilişkili olabilir. Çünkü, krom, hücresel düzeyde kromodulin yapısını tamamlamakta ve optimum insülin etkisinin oluşmasına yardımcı olmakta, ve ayrıca glikoz tolerans faktörü olarak görev yapmaktadır 17,20,47. Örneğin, Anderson ve ark. 27 organik krom bileşikleri ile yaptıkları bir çalışmada CrHis preparatının diğer organik krom bileşiklerinden daha iyi absorbe edildiğini ve organizmada daha yüksek konsantrasyonda bulunduğunu bildirmişlerdir. Öte yandan, GLP-1R nakavt farelerde yapılan bir çalışmada insülin direnci durumunda pankreas islet hücreleri sayısında ve büyüklüğünde kontrol farelere göre anlamlı bir azalma olduğu bildirilmektedir 46. Bu durum insülin sentezi ve sekresyonu ile ilişkilendirilebilmektedir.
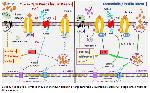
Organik krom bileşiği olan CrHis ve izomerleri hücresel düzeyde kromodulin yapısı ile insülin sinyalizasyonunu iyileştirmekte ve YYD ile indüklenen insülin direncini azaltıcı yönde bir etki göstermektedir. İnsülin reseptör etkinliğini artıran CrHis, artan IRS-1 protein düzeyi ve artan GLP-1R etkisi ile pankreas β-hücrelerinin proliferasyonunu stimule ederken, apoptozisini baskılayıcı etki göstermesini sağlayacak ve insülin direncinin diyabet gibi kronik bir probleme dönüşüm riskini azaltabilecektir (Şekil 4). Sonuç olarak, CrHis ve izomerleri YYD ile beslenen sıçanlarda pankreas GLUT-2, IRS-1 ve GLP-1R sinyalizasyonlarını düzenleyebilmektedir. Bu durum obezite, metabolik sendrom ve diyabet gibi durumlarda etkili insülin direncinin kontrol altına alınmasında umut verici olabilir.
Büyütmek İçin Tıklayın |
Şekil 4: Yüksek yağlı diyet ile indüklenen insülin direncine karşı pankreas β-hücresinde krom (Cr) bileşiklerinin hücresel düzeyde yanıtı. |
Teşekkür
Bu çalışmaya desteklerinden dolayı Nutrition21 (NY, ABD)e ve Türkiye Bilimler Akademisine (TÜBA, KS) teşekkür ederiz.