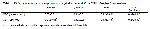DOX kanser hastalarının tedavisinde yaygın olarak kullanılmasına rağmen, etki mekanizması hala iyi bilinmemektedir. DOXin hem antikanser etkilere sahip olup hem de kalp ve diğer organlarda toksisiteye neden olmasında çeşitli mekanizmalara sahip olduğu görülmekte olup ilk retrospektif klinik çalışmalarda gözlenen kardiyak rahatsızlıkların DOX uygulamasına bağlı oluştuğu bildirilmiştir
22,23.
DOXin neden olduğu kalp hasarının patogenezi multifaktöriyeldir ve ilacın metabolizması ve antitümör aktivitesi ile doğrudan ilişkilidir. DOX kaynaklı kardiyotoksisitenin önemli özelliklerinden biri etkilerin doza bağımlı oluşudur 22,24.
Serbest radikaller, aşırı kalsiyum yüklenmesi ve mitokondriyal disfonksiyon, DOX kaynaklı kardiyotoksisitede ana tetikleyicilerdir 25. DOX kaynaklı oksidatif stresin seviyesi, kalpte diğer dokularda (karaciğer, böbrek, dalak) olduğundan 10 kat daha yüksektir 26.
DOXin indüklediği kardiyotoksisitenin patogenezinin halen dahi iyi anlaşılmamış olmasına rağmen, kardiyotoksisitesinin ana mekanizması olarak serbest radikal oluşumu öne sürülmüştür 27. MDA, çoklu doymamış yağ asitlerinin önemli bir oksidasyon ürünüdür ve artan MDA içeriği, lipit peroksidasyonunun önemli bir göstergesidir. Çalışmada, kontrol grubuna göre DOX uygulanan grupta MDA düzeylerinin anlamlı olarak yükseldiği saptanmıştır. MDA seviyesindeki artış DOXin oluşturduğu hasarın bir göstergesi olarak düşünülebilir. DOX uygulanan grupta MDA seviyesindeki yükselme, hücresel bileşenlerle, özellikle hücre zarında çoklu doymamış yağ asitleri ile reaksiyona giren ve MDA seviyesini yükselten demir iyonlarının salınmasına yol açan DOXin metabolizması ile ilgili olabilir 28.
DOXe bağlı toksisitenin patogenezinde antioksidan enzimlerin ve serbest radikal rol oynadığına ait bilgiler mevcuttur 29-32. İliskovic ve ark. 29 DOX uygulamasından sonra kalp dokusunda MDA düzeyinde anlamlı artış ile beraber GSH-Px aktivitesinde anlamlı bir düşüş saptadıklarını bildirmişlerdir. Luo ve ark. (30) 10 mg/kg tek doz DOX verilen ratların kalp dokusunda MDA düzeyinin yükseldiğini göstererek, DOXin MDA veya benzer başka sitotoksik maddelerin salınımını indükleyerek kardiyotoksisiteyi başlattığını ileri sürmüşlerdir. Chopra ve ark. 31 ratlar üzerinde DOX uygulaması (10 mg/kg) ile oluşan kardiyotoksisite üzerine propolis uygulamasının etkilerini inceledikleri çalışmalarında kan ve dokuda GSH ve tiyobarbitürat reaktif madde düzeylerininin DOX uygulaması sonrasında yükseldiğini bildirmişlerdir. Alyane ve ark. 33 ratların kalp dokusunda DOX (20 mg/kg) uygulamasından 24 saat sonra MDA ve O2.- seviyelerinin yüksek olduğunu gözlemlemişlerdir. Park ve ark. 34 ratlarda DOX uygulanası ile deneysel bir toksisite meydana getirip N-asetilsisteinin ve selenyumun koruyucu etkilerini inceledikleri çalışmada kalp dokusu başta olmak üzere birçok dokuda, MDA düzeyinin DOX verilen grupta yükseldiğini, tedavi gruplarında ise düştüğünü tespit etmişlerdir. Narin ve ark. 35 tavşanlarda yaptıkları çalışmada DOXe (15 mg/kg i.p.) uygulaması sonrası kalpte meydana gelen toksisitenin patogenezinde kalp dokusundaki antioksidan enzim aktivitelerinde bir azalma, lipid peroksidasyon ürünlerinde ve serbest radikal düzeylerinde ise artmanın rol oynayabileceğini tespit etmişlerdir. Demir ve ark. 36 DOX verilen tavşanlarda miyokardiyal MDA düzeyinin arttığını, GSH-Px aktivitesinin azaldığını saptamışlardır ve DOXe bağlı kardiyotoksisitenin patogenezinde miyokardiyal lipid peroksidasyonunda artış ve antioksidan sistemlerdeki azalmanın rol oynayabileceğini göstermişlerdir. Xu ve ark. 37 ratlara DOX ve deferipion uyguladıkları çalışmada DOX uygulanan grupta sol atrium dokusunda SOD ve suksinat dehidrogenaz ativitelerinde düşme, MDA düzeyinde artış belirlemişlerdir. Chularojmontri ve ark. 38 rat kardiyak hücre kültüründe yaptıkları biyokimyasal çalışmada DOXin verdiği hasarda hücrelerin antioksidan kapasitesini ve bunun vitamin E ve vitamin C ile değişimini araştırmışlar, DOX verilen grupta KAT, SOD aktiviteleri ile GSH düzeylerini kontrol grubuna göre düşük, vitamin C ve vitamin E gruplarında yüksek olarak bulmuşlardır. Bolaman ve ark. 32 tek doz 10 mg/kg dozunda DOX uygulayarak akut kardiyotoksisite meydana getirilen ratlarda amifostinin koruyucu etkilerini araştırmışlar, DOX uygulaması sonrası kalp dokusunda MDA düzeyinin arttığını, diğer antioksidan enzim düzeylerinin ise anlamlı olarak düştüğünü tespit ederek amifostinin DOX kardiyoksisitesini azaltabileceği sonucuna varmışlardır.
DOX kardiyotoksisitesi ile ilgili olarak, kalp dokusunun, yüksek oksidatif metabolizmaya sahip olması ve antioksidan savunma mekanizmalarının karaciğer gibi diğer organlardan daha az olması nedeniyle serbest radikal hasarına karşı çok duyarlı olduğu bilinmektedir 39,40. Bu çalışmanın sonuçları, tek bir DOX dozunun ratlarda toksisiteye neden olduğunu doğrulamıştır. Çalışmada, DOX uygulanan ratların kalp dokusunda, MDA ve GSH seviyeleri anlamlı derecede yükselmiş, SOD hariç antioksidan enzim aktiviteleri ise azalmış olup, DOX kardiyotoksisitesinde radikallerin büyük bir rol oynadığı hipotezi desteklenmiştir. Çalışmadaki bulgular DOXin meydana getirdiği oksidatif stresteki yükselişe nedeniyle aktif serbest radikallerin oluşumuna sebep olabileceğini düşündürmektedir. Bazı araştırıcılar (38) oksidatif strese sonucu bazı dokularda GSH düzeylerinde düşüş saptamışlarken, bazı araştırıcılar 31,40 ise meydana gelen oksidatif hasarın GSH düzeylerini artırabileceğini belirlemişlerdir. Çalışma sonucunda DOX uygulaması sonrası GSH düzeylerinde gözlenen artış dokuların oksidatif strese karşı bir tepkisi olabileceği şeklinde değerlendirilmiştir. Ayrıca GSH düzeyindeki artış, GSHun GSSGa dönüşümünü katalize eden antioksidan bir enzim olan GSH-Px aktivitesindeki düşüş GSHun GSSGa dönüşümünü engellemiş olabileceği şeklinde de yorumlanabilir. GSH, sayısız elektrofilik ve oksitleyici bileşiklerle etkileşim kurarak, hem nükleofil hem de etkili indirgeyici görevi gören başlıca hücresel -SH bileşiğidir. -SH grubunun serbest oksijen radikalleri ile direk etkileşimi ile non-enzimatik bir antioksidan olarak görev yapabilir veya bir koenzim olarak serbest oksijen radikalleri için enzimatik detoksifikasyon reaksiyonunda görev alabilir 41. GST, birçok toksik maddelerin vücut dışına atılmasını sağladığı gibi, prostoglandinlerin izomerizasyonu, safra tuzları, hem, bilirubin ve yağ asitleri gibi nonsubstrat ligandları GSH ile bağlayarak daha kolay şekilde taşınmasını da sağlamaktadır. Aynı zamanda reaktif elektrofilik bileşiklerin organizmada hasar oluşturmasını, aynı tür bileşikleri birbirine kovalent bağlayarakta engelleyebilmektedir 40 GST aktivitesindeki azalış, DOXin metabolizması sırasında reaktif oksijen türleri oluşumuyla mücadele etmek için hücrede GSHa bağlanarak taşınan zararı maddelerin artışına cevap olduğu şeklinde yorumlanabilir. DOX uygulamasından sonra KAT, GSH-Px ve GST gibi antioksidan enzim aktivitelerindeki azalma ise DOXin metabolizması sırasında serbest radikal üretiminde bir artışla açıklanabilmektedir.
Çeşitli maligniteler için sıklıkla kullanılan bir kemoterapötik ajan olan DOXin kardiyotoksik etkilerinin hafifletilmesi amacıyla bazı antioksidan ajanların toksisite şiddetini düşürerek, daha etkili ve daha yüksek dozların uygulanmasının mümkün olabileceği belirtilmiştir.
Yapılan birçok çalışma 10,42-46, çörek otu tohumu ve bileşenlerinin antioksidan, antitümöral, antikanserojenik, antiinflamatuar ve analjezik, bağışıklık sistemini güçlendirici, antiülserojenik, hipoglisemik, antibakteriyel etkilere sahip olduğunu göstermektedir. Uz ve ark. 11 çörek otu yağının siklosporin A ile indüklenen kardiyomiyopati üzerindeki etkilerini inceledikleri çalışmalarında çörek otu yağı ile muamelenin, lipid peroksidasyonunu azalttığı, hücresel protein oksidasyonunu ve antioksidan enzimleri iyileştirdiği, kardiyak histopatolojiyi normale döndürdüğü bulunmuşlardır. Son çalışmalar 47,48, DOX kaynaklı toksisiteye karşı çörek otunun etkin maddesi olan timokinonun koruyucu bir etkisi olduğunu ortaya koymuştur.
Nagi ve ark. 49 ratlarda siklofosfamide bağlı kardiyotoksisiteye karşı tikokinonun olası koruyucu etkileri incelendikleri çalışmalarında timokinon ilavesinin, siklofosfamidin kan ve kalp dokusunda neden olduğu biyokimyasal değişiklikleri düzelttiğini belirlemişlerdir. Araştırmacıların sonuçları, timokinonun faydalı etkilerinin, antioksidan özelliklerinin yanı sıra, kalp dokularındaki mitokondriyal fonksiyonu ve enerji üretimini iyileştirme kabiliyetine atfedildiğini göstermektedir.
Al-Shabanah ve ark. 47 farelerde timokinonun DOX kardiyotoksisitesini hafifletebilecek seçici sitoprotektif bir ajan olabileceğini bildirmişlerdir. Nagi ve Mansour 48 ratlarda DOX (15 mg/kg i.p. tek doz) ile oluşturulmuş kardiyotoksisiteye karşı timokinonun lipid peroksidasyonunu inhibe ettiğini, O2.- süpürücüsü olduğunu ve DOXin neden olduğu kardiyotoksisiteye karşı koruyucu etkisi olduğunu bildirmişlerdir.
Çalışmada, çörek otunun DOX ile oluşturulan kardiyotoksisitede lipit peroksidasyonun azaltılmasında ve azalmış olan antioksidan enzimlerin aktivitelerinin artırılmasında etkili bir ajan olduğu düşünülmüştür.
Sonuç olarak, DOX uygulanan ratlarda lipid peroksidasyonun arttığı, antioksidan aktivitelerin azaldığı, DOX ile beraber çörek otu yağı verildiğinde ise olarak MDA, GSH düzeyleri ve antioksidan enzim aktivitelerinin kontrol grubuna yaklaştığı saptanmıştır. MDA ve GSH düzeyleri ve antioksidan enzim aktivitelerinin düzelmesi çörek otu yağının DOX kaynaklı serbest radikal üretilmesini sınırlayarak, antioksidan savunma sistemini artırarak, oksidatif stresi önleme yeteneğine sahip olması ile açıklanabilir. Bu sonuçlar, çörek otu yağının DOX kardiyotosisitesine karşı kalbi koruyabileceği düşündürmektedir.