Lipozomlar, ilaç taşıyıcı sistemlerden biri olup, tek tabaka veya yapılarında sulu faz içeren iç içe birkaç tabakadan oluşan, 0.02 - 3.5 μm çapında küresel keseciklerdir. Alec Bangham tarafından 1960'larda hücre membranına model oluşturması için açıklanmış ve fosfolipidlerin hücre zarlarına benzeyen lipid tabakalarla çevrili kapalı vezikülleri oluşturma kabiliyeti gösterilmiştir
1,2.
Toksik olmayan, aynı zamanda bağışıklık da oluşturmayan lipozomlar; suda ve yağda çözünen etken maddeleri içeren, etken maddeleri kontrollü olarak salıverebilen, bu etken maddeleri hedef bölgeye taşıyabilen ve biyolojik olarak yıkımlanabilen yapıdadırlar 1.
Lipozomların temel yapıları hücre membranı yapısına çok benzediğinden, in vitro araştırmalarda uzun yıllardır model membran olarak kullanılmaktadırlar. Ayrıca, lipozomlar ilaç taşıyıcı sistemi olarak da kullanılabilmeleri nedeniyle son yıllarda üzerinde çok çalışılan ve araştırmaların ilgi odağı konumunda yer almaktadırlar 1,3.
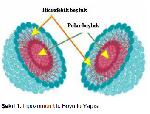
Yunancada yağ anlamına gelen Lipos ve vücut anlamına gelen Soma kelimelerinden Lipozom kavramı türetilmiştir. Şekil 1de görüldüğü gibi üç boyutlu dış görünüşü bir topu andıran lipozomlar hem hidrofilik polar hem de hidrofobik apolar boşluklar içermektedir 4. Bu sayede suda çözünebilen maddeleri polar boşluklarında, yağda çözünebilen maddeleri ise hidrofobik boşluklarında kapsülleyerek bunlar için bir taşıyıcı vazifesi görürler 4-7.
1. LİPOZOMLARIN HAZIRLAMA YÖNTEMLERİ
Lipozomların hazırlanmasında en çok fosfatidilkolin (Lesitin), daha az olarak Disetilfosfat ve Stearilamin gibi diğer maddeler kullanılır. Fosfolipitler suya eklendiklerinde, suyu seven ve emen (hidrofilik) bölgeler suya doğru yönelirken, suyu sevmeyen ve emmeyen (hidrofobik) bölgeler sudan uzaklaşarak kesecik (vezikül) şeklini alır. Böylelikle Şekil 2 (a) ve (b)de görüldüğü gibi tek (monolayer) ve çok tabakalı (multiple layer) lipozom şekilleri oluşur 4. Çift tabakalı lipozom yapısının oluşmasını fosfolipitler ile su fazıu arasındaki hidrofobik etkileşimler ile fosfolipit moleküllerinin içerdiği Van der Waals bağları sağlar 8.
Hazırlama yöntemlerinin farklılıklarından dolayı,
çok tabakalı (Multi Lamellar Vesicle (MLV)) ve küçük tek
tabakalı (Small Unilamellar Vesicle (SUV)) ile büyük tek
tabakalı (Large Unilamellar Vesicle (LUV)) lipozomlar
oluşturulur. Lipozomlar tabaka sayısı, büyüklük dağılımı
ve hazırlama yönteminden doğrudan etkilenebilir. Bu
nedenle amaca yönelik en uygun yöntem seçilmelidir 9.
1.1. Multilamellar Veziküller (MLV)
Hazırlama Yöntemi
Lipozom bileşimine girecek lipitler kloroform gibi
organik çözücülerde çözdürülür ve çözücü maddenin
gaz azot yardımıyla uçurulmasıyla lipid film elde edilir.
Bir tampon çözelti aracılığıyla lipit film, oda sıcaklığında
hidrate edilir. Hidrate edilen lipit film, anafaz geçiş
sıcaklığının üstünde bir sıcaklıkta (+20 ⁰C)de su içinde
birkaç dakika bekletilir. Buradan çıkarılan lipid film birkaç
dakika süreyle vorteksle çalkalanır. Çok tabakalı
lipozomların eldesi için, bu işlemlerin onbeş dakika
boyunca devam ettirilmesi gerekir (Şekil 3a)4,9.
1.2. Küçük (SUV) ve Büyük Ünilamellar
Veziküller (LUV) Hazırlama Yöntemi
Kuru lipit film hidrasyonuyla elde edilen heterojen
ve büyük çok tabakalı lipozomların büyüklüğü ve
tabakaların özelliklerini değiştirmede çeşitli işlemler uygulanmaktadır. Bu işlemlerin başlıcaları sonikasyon,
ekstrüzyon, vortekslemedir. Bu yöntemler sayesinde
MLVler SUV veya LUV haline dönüştürülürler (Şekil 3b).
Lipozomları ayırmada por çapına göre lipozom
ekstrüzyon cihazı kullanılır. Eğer lipozomlar küçük çapa
sahipse porlardan geçerek ayrışırlar. Sonikasyon
cihazıyla MLVlere yüksek düzeyde enerji uygulanarak
SUV elde edilebilir. SUV ve LUV eldesi için diğer
yöntemde ise, çözücü olarak deterjan kullanılır ve bu da
proteinlerin lipit-protein karışımından ayrıştırılmasını
sağlar. Burada tampon çözelti işlevini kolloidler üstlenir.
Santrifüj, jel filtrasyonu veya hızlandırılmış diyaliz
yöntemlerinden deterjanın ortamdan uzaklaştırılmasında
faydalanılır4,9-11.
2. LİPOZOMLARIN DAYANIKLILIKLARI VE
ETKİLEYEN FAKTÖRLER
Lipozomların tam çözülememiş problemlerinden
biri elde edilmelerinden kullanılmalarına kadar geçen
süredeki kimyasal ve fiziksel dayanıklılıklarıdır 12.
Lipozomların ilaç taşıyıcısı olarak kullanılmasında iki
önemli sorun ortaya çıkmaktadır. Bunlardan birincisi,
lipozomların uygulandıklarında bütünlüklerini
koruyamadıkları için, etken maddenin hedef bölgeye
ulaşmadan kanda salınması; ikincisi ise lipozomların
Retiküloendotelyal sistem (RES) hücrelerinde tutularak
hedef hücrelere ulaşamamasıdır 13.
Fiziksel ve kimyasal dayanıklılıklarının
sağlanmasında öncelikle lipozomun bileşimi, etkili
maddenin tutulduğu faz, büyüklüğü, yükü, hazırlanma
şartları ve etkili maddenin fizikokimyasal özellikleri gibi
faktörler rol oynamaktadır 1,3,14,15.
2.1. Lipozomların Kimyasal Stabilitesi
Lipozomların temel yapılarını oluşturan
fosfolipidlerin kimyasal dayanıklılığını etkileyen en temel
faktördür. Lipozom yapısındaki fosfolipidler, oksidasyon
ve hidrolizle kimyasal parçalanmaya uğrarlar 16.
2.1.1. Oksidasyon (Lipid Peroksidasyonu)
Doğal fosfolipidlerin yapısı, oksidatif hidrolitik olaylarla bozulmaya uygundur. Lipozomların yapısına katılan fosfolipidlerin moleküler yapılarındaki doymamış Açil zincirleri oksidatif parçalanmaya uygundurlar. Bu nedenle yapılarında doymamış yağ asidi bulunan fosfolipidlerle hazırlanan lipozomlar lipid peroksidasyona uğramaya meyilli hale gelirler. Örnek olarak, lesitin'in oksidasyonuyla oksi-peroksi ve epoksi gibi metabolitler meydana gelir. Daha sonra bu metabolitler karbonil bileşikleri, hidrokarbonlar ve furanlara dönüşüp bozulurlar. Ayrıca, zehirli bozulma ürünleri de meydana gelebilir 14,16,17.
İstenmeyen lipid peroksidasyonun bir kaç yöntemle minimum seviyeye indirilmesiyle lipozomların kimyasal stabilitesinin korunabileceği bildirilmiştir. Bu yöntemler; doymamış fosfolipidlerin en az düzeyde kullanılması, ortamdaki oksijen varlığının azot ve argon gazı kullanılarak azaltılması, ortamdan ağır metallerin uzaklaştırılması ile α-tokoferol gibi antioksidanlardan yararlanılmasıdır 15,17,18.
2.1.2. Hidroliz (Yağ Asit Esterlerinin Hidrolizi)
Fosfolipidin zincir uzunluğu ve yapısı, iyonik güçler, ortam pHsı, sıcaklık, süre ile kullanılan tampon özellikleri hidroliz olayında en etkili faktörlerdir. Lesitin'in hidroliziyle lizo-lesitin oluşumu, fosfolipid molekülündeki ester bağlarının su varlığında hidrolize olmasına örnektir. Lipid tabakalarda belli miktarda lizo-lesitin bulunması lipozomların dayanıklığını artırtırmaktadır ve lizo-lesitin oluşumunun fosfolipidlerin kimyasal dayanıklılığını sağlayan bir etken olarak düşünülmüştür. Diğer yandan, depolamada ise lizolesitin oluşumu belli sınırların üzerine çıkmaması gereklidir. Hazırlamada faydalanılan sonikasyon ve benzeri yöntemler de lizolesitin oluşumunu etkiler. Fosfolipid miktarı en uygun şekilde ayarlanarak lizo-lesitin oluşumu kontrol edilebilir 19,20.
2.2. Lipozomların Fiziksel Dayanıklılığı
Lipozomların fiziksel dayanıklılığı; yapısı, etkili maddenin hidrofilik veya hidrofobik olması ile depolanma şartlarına bağlılık göstermektedir 1,15,21.
Lipozom preparatlarının fiziksel özelliklerinde oluşan değişimler genellikle keseciklerin bir araya toplanması (aggresgasyon) ya da lipozomun hacim olarak büyümesi şeklindedir. Lipozomların zar yapısında, üretim esnasında keseciklerde oluşan sızma ile füzyon olaylarına bağlı olarak hasarlar oluşmaktadır. Bu duruma özellikle SUVlerin faz geçiş sıcaklığı altında hazırlanmasında rastlanırken, faz geçiş sıcaklığı üzerinde hazırlanmasında da membran yapısında hasarlar meydana gelebilir. Tek tabakalı lipozomlarda daha çok meydana gelen etkili maddenin lipozomdan dışarı geçmesi olayına, çok tabakalı lipozomlarda az rastlanır. Çok tabakalı lipozomun, lipid tabakada tutulan etkili maddenin dışarı sızması sulu fazda bulunan etkili maddenin geçişine göre daha zor olur 21.
Lipozomlardan küçük molekül ağırlıklı maddelerin dışarı geçişleri daha kolay olurken, büyük molekül ağırlıklı (MA > 1000) maddelerin dışarı geçişleri daha zor olmaktadır. Van der Waals bağları nötral lipozomların bir araya toplanması ve çökmelerine yol açabilir. Bundan dolayı zarların birbirleriyle temas etmesi daha büyük yapıların oluşması ve böylece zar tabaka sayısı artış ve büyük keseciklerin oluşumuna neden olur. Nötr lipozomlarda bu durum çok daha fazla görülür. Artık çözücülerin iyi uçurulmaması ve iz elementlerin olması bu olaya katkıda bulunarak bu durumu arttırabilirler. Tek tabakalı lipozomlar, faz geçiş sıcaklığında, özellikle membranın eğrisel yapısından ileri gelen direncin az olması sebebiyle geçişe (füzyon) daha çok meyillidir. Faz geçiş sıcaklığında meydana gelen bu olayı engellemek için lipozom dispersiyonları faz geçiş sıcaklığından farklı bir sıcaklıkta saklanmalıdır. Zar yapısına yeterli kolesterol ilavesiyle faz geçişi azaltılmış veya ortadan kaldırılmış olur. Lipozom zarlarının geçirgenliği, lipid tabaka ve lipozomda tutulan etkili maddenin yapısına bağlıdır. Lipozom zarları arasında bulunan özellikle polar veya iyonize büyük maddeler, küçük molekül ağırlığına sahip lipofilik maddelerden daha etkili tutulmaktadırlar 14,15,19.
3. LİPOZOMLARIN KULLANIM ALANLARI
3.1. Lipozomların Beşeri ve
Veteriner Hekimlikte Kullanılması
Lipozomların farklı doku ve hücreleri etkilemeleri, yüzeylerinin farklı özellikteki molekülleri taşıması, sağlar. Lipozomlar kanser, dermatolojik, paraziter ve bakteriyel hastalıklar, enzim eksikliği tedavisi, akut-kronik ağrıların giderilmesi, şelat yapıcı ajanların taşınması ve aşılama gibi amaçlarla kullanılmaktadır.
Lipozomlardan sağlık alanında yararlanmasında en önemli sorunlardan biri, vücudun fagositik sistemlerince immunolipozomların yok edilmesidir. Bu sorunu çözmek için, lipozom yüzeyinin bağışıklık sistemini aktive etmeyen moleküllerle kaplanması denense de, tedavi amaçlı kullanılan lipozomlarla istenen çözüm elde edilememiştir 22.
Bağışıklık sistemi zayıf olan hastalarda kullanılan ilaçlar nefrotoksik ve nörotoksik etki gösterebilmektedir. Bu zehirli maddelerin etkileri başka ilaçlarla bağ yaptırılarak veya lipozomlarla enkapsüle edilerek büyük ölçüde azaltılmış olur 23. Genellikle antibakteriyel ve antiviral tedavilerde kullanılan etkili maddeler doğrudan alınırlar, ancak bunların çok zehirli olanları enkapsüle edilerek lipozomlarla kullanılmaktadır 24.
3.1.1. Lipozom Tabanlı Kanser Tedavileri
Modern kanser tedavisi birçoğu kemoterapötik olan birkaç antineoplastik ajan içermektedir. Bu ilaçlar in vitro ortamda kanser hücrelerini ortadan kaldırmada güçlü etkinlik gösterirler. Fakat in vivo etkinlik için önemli engellerle karşılaşırlar. 25. Bu engeller kanser hücreleri için seçiciliğin yoksunluğu, tümör bölgelerinde düşük biyoyararlanım, daha büyük hacimlerde dağılım ve normal dokulara toksisitedir 26. Tedavi için kan dolaşımına doğrudan verilen lipozomlarla istenen sonuçlar sağlanamamakla birlikte, nanoparçacık bazlı kanser terapötikleri son yıllarda kapsamlı bir şekilde değerlendirilmektedir 25,27.
Lipozomlar gibi nanoteknoloji tabanlı ilaç sistemleri bu engelleri birçok mekanizma yoluyla aşarlar. Küçük boyutlara sahip olmalarından dolayı (10-100 nm) hücre içi alımı için ideal, yüksek kapsüllenme yeteneğine sahip ve tümörün spesifik hedeflenmesi için tasarlanabilmektedirler 25,26. Ayrıca, tümör dokusu vaskülaritesinde bozulma ve yoğun şekilde zarar görmüş lenfatik drenaj gibi özellikleri nanoparçacıkların tümör içinde birikmesine izin verir. Katı tümörlerdeki kan dolaşımının yetersizliğinden dolayı, tedavi amaçlı kan dolaşımına verilen lipozomlar ile istenilen sonuç sağlanamamıştır. 22,25.
Lipozomlar, hayvanlarda antikanser ilaçların verilmesi için umut vadeden bir gelişme ortaya koymuştur. 1995in sonlarında Canine Splenic Hemangiosarkomlu köpeklerde yapılan klinik denemelerde, lipozom kapsüllü muramyl tripeptit (fosfatidilethanolamin) geliştirilmiş ve bununla konjuge edilen Doksorubisin tedavisinde köpeklerin hastalıksız hayatta kalma süreleri uzamıştır. Bu çalışmalar, veteriner onkolojide lipozom temelli kanser tedavilerinin, insanlardaki kadar önemli, cesaret verici sonuçlarının olduğunu göstermiştir 28. İnsanlarda lipozom kapsüllü Doksorubisin serbest Doksorubisine göre daha az kardiyotoksisite ve farmakokinetik özelliklerde önemli değişiklikler göstermiştir. Doksorubisin içeren polietilen glikollenmiş lipozomların (Doxil ve Caelyx gibi) klinik kullanım için uygun olduğu bildirilmiştir 29.
Lipozom formulasyonlarının diğer kanser (tümör) tedavileriyle birlikte kullanılması veteriner onkolojiye çok yönlü bir yaklaşım da sağlamıştır. Lipozom tabanlı ilaçlar in vivo, daha uzun süreli dolaşıma sahip olduklarından dolayı kanserde radyoterapi tedavisi öncesinde sensitizörler olarak lipozomlara yüklenebilir. Yumuşak doku sarkomları olan kedilerde, günlük palyatif radyoterapiye ek olarak Doksorubisin verilince önemli terapötik iyileşmeler olduğu ortaya konmuştur. Küçük örnek büyüklüğüne rağmen 237 gün kullanım süresince 10 kediden 5 tanesinde kısmi, 2 tanesinde ise tamamen iyileşme görülmüştür 30.
3.1.2. Lipozom Tabanlı Antibakteriyel ve Antiparaziter İlaçlar
Genel olarak ilaçlar, ilaç ve patojen türüne bakılmaksızın NPler tarafından taşınırken daha iyi etkinlik sunmaktadır. Hem inorganik hem de organik NPler, farklı ilaç türlerinin (antimikrobiyal, antiviral, antifungal ve antiparaziter) aktivitelerini ve patojenlere karşı etkinliklerini teşvik eden diğer maddelerinde etkilerini arttırmaktadırlar 31-35.
NPlerin kullanımı, ilaç etkinliğinin geliştirilmesinin yanı sıra, daha hasta dostu rejimleri mümkün kılmaktadır. Hedef olmayan dokularda daha düşük miktarda biriken ilacın yan etkileri ve toksisitesi azalmaktadır. Organik NPlerle birleştirilerek hazırlanan asiklovir, lamivudin, amfoterisin B, primakin gibi ilaçların oluşturduğu hematolojik sorunların ve nefrotoksik etkilerinin azaldığı bildirilmiştir 31,34,36-39. Ayrıca, ilaç içeren NPlerle tedaviden sonra, mikroorganizmalarda direnci tekrardan uyarma olasılıklarının daha düşük olduğu gösterilmiştir. NPler bakterilere saldıracak çok işlevli mekanizmalara sahiptir, bu nedenle serbest ilaç tedavisinden sonra oluşan direnç, NPlerle tedavi edilenlere oranla çok daha yaygındır 40-42.
Bakteri biyofilmlerinin, biyolojik yüzeylere yapışan kompakt bakteri kümeleri olduğu, nüfuz etmesi zor bir hücre dışı polimerik matris ürettikleri ve böylece ilaç direncini arttırdıkları belirtilmiştir. Bunlar, genellikle ulaşılması zor bölgelerde lokalize olduklarından mevcut tedaviler nadiren başarılı olur 43-45.
Lipozomların damar yoluyla verilmesiyle fagositik sistemce yok edildiğinin anlaşılmasıyla lipozom aracılı ilaç taşınımı makrofajlara sağlanmıştır. Bu durumda lipozomlar, fagositik hücrelerdeki parazitlere karşı tedavilerde önemli rol oynamışlardır. Leishmaniniasis ve mantar enfestasyonları bu parazitlerin neden olduğu hastalıklardan en sık görülenleridir. Bu hastalıklarda kullanılan lipozomlar enfekte bölgede yoğun bulunur ve biriken lipozomların zehirli etkileri daha azdır. 46.
Birdane ve Baş 10, koyunlarda serbest ve lipozomal ampisilini damar içi vererek kan farmakokinetik değerlerinin karşılaştırılmasını yapmışlardır. Çalışmada, lipozomal formda ampisilin kullanımıyla etkili kan düzeylerinin uzun süre korunabilmesiyle sık aralıklarla ilaç kullanımının engelleneceği, doza bağlı yan etkilerin azalacağı, eşit miktar etken madde kullanımıyla in vivo ortamda daha uzun süre antibakteriyel etkinin sağlanabileceği görüşüne varmışlardır.
Lee ve ark. 11, tarafından yapılan çalışmada, PLGA ve poloksamer (POL)den oluşan marbofloksasin (MAR) içeren, intramüsküler enjekte edilebilir polimerik mikropartiküller (MP) (kapsüller) geliştirilmiştir. Sonuçlar, MAR-MP'nin yüksek bir yükleme verimi olduğunu ve hidrofilik ilaçların kapsüllenmesi için diğer MP'lere kıyasla yüksek seviyede ilaç içerdiğini ortaya koymuştur ve MAR-MP'nin veteriner hekimlikte sürekli bir ilaç salınım taşıyıcısı olarak uygun olduğunu, antibiyotiklerin kötüye kullanımını azaltabileceğini saptamışlardır.
Hrckova ve Velebny 47, tarafından laboratuar farelerinde Mesocestoides corti tetrathyridia enfeksiyonlarında serbest ve lipozomlanmış albendazolün her iki formülasyonunun M. corti enfeksiyonunun ortadan kaldırılmasında kısmen etkili olduğu saptanmıştır.
Antibiyotiklerle etiketlenmiş NPlerin kullanımı bu tip enfeksiyonları tedavi etmede yardımcı olmaktadır. Nafsilin, vankomisin ve daptomisin gibi antibiyotikler osteoblast zardan geçmeyi kolaylaştırmakta ve hücre içi bakterilere daha iyi nüfuz etmektedirler 48,49. Ayrıca, alendronat veya kalsiyum gibi ligandlar, kemik dokusunca yüksek afiniteye sahip olması nedeniyle ilaç hedeflemede tercih edilmektedirler. NPlerin diğer bir avantajı da, kronik hastalıklarda terapötik rejimi iyileştirerek yıllarca sürebilen sürekli salınımıdır 50,51.
3.1.3. Lipozom Tabanlı Analjezi
İnsan ve hayvanlarda akut ve kronik ağrıların tedavisinde kullanılan birçok farmakolojik madde, yüksek dağılım hacmine ve sistemik yarılanma ömrüne sahiptir.
Ağızdan kullanılan ağrı kesicileri insanlar kendileri alabilirler. Veteriner ağrı yönetiminde ise sık doz ve sıkı uygulama protokolleri, yüksek lojistik maliyetleri gerektirmekle birlikte hayvanlarla ilgilenen işçilerin zoonotik enfeksiyon riskini artırır. Bu engellerin üstesinden gelmek için yeni ilaç dağıtım sistemleri sürekli geliştirilmektedir 52-54.
Sıçanlarda ağrı tedavisinde lipozomal bupivakainin sızma kapasitesi üzerine yapılan çalışmada, depo formülasyonlarının daha etkili olduğu gösterilmiştir. Çeşitli hayvan türlerinde lipozom kapsüllü analjeziklerin farmakokinetik ve farmakodinamiklerini inceleyen çalışmalar ve teknolojik gelişmeler farklı analjeziklerin lipozomlara dahil edilmesini sağlamıştır 55.
Opioidler, lipozomal salınım için en yaygın olarak incelenen analjezik ilaç olarak kalmaya devam etmektedir 53,57. Sıçanlarda oluşturulan nöropatik hiperaljeziyi önlemede lipozom kapsüllü oksimorfonun (LE-oksimorfon) ve lipozom kapsüllü hidromorfonun (LE-Hydro) etkileri araştırılmıştır. LE-Hydro'nun, sıçanlara uygulanmasını takiben 5 gün süreyle hiperaljeziyi önlediği sonucuna varılmıştır. 54,56-58.
Lipozomları, veteriner hekimlikte analjezik salınım, davranışsal ve farmakodinamik cevapları değerlendirmek için köpekler gibi daha büyük hayvanlarda da çalışmalar yapılmıştır. Bir farmakodinamik araştırmada sağlıklı Beaglelarda, LE-Hydro'nun yan etkileri ve aynı hastanede ovariohistektomi (OVH) geçiren diğer köpeklerde analjezik etkinliğinin belirlenmesi incelenmiştir. LE-Hydro kullanımıyla solunum depresyonunun iyi tolere edildiği saptanmıştır. Bu çalışmanın, lipozomların opioidler için toksik olmayan ve sürekli salınan formülasyonlar gibi hareket edebildiğini tespit etmede hayati önem taşıdığı bildirilmiştir 59.
3.1.4. Aşılarda Lipozomlar
Aşılarda sağlanan faydanın arttırılması amacıyla da lipozomlardan faydalanılmaktadır. Lipozomal aşı hazırlanmasında lipozomun içindeki sulu bölgeye suda çözünen maddelerin, lipitte çözünen maddelerin ise kesecik oluşumu esnasında lipit tabaka karıştırılır. Birçok hücre tarafından absorbe edilen lipozomlar, hücre içine girdiğinde içerdikleri maddeleri salar. Böyle hazırlanan lipozomal aşılar makrofajlarda dahil olmak üzere diğer fagositik hücreleri hedef almaktadırlar 60.
Aşı tasarımı için uygun yapılar olarak değerlendirilen lipozomlar, uygun antijen eklenerek verilmelerinden sonra, irer girmez ierdikleri antijeni hücreye salarlar. Bu antijenle hücrelerin karşılaşmasıyla bir immun yanıt meydana gelir. 61,62. Bu nedenle lipozomlar gibi nanoparçacık dağıtım sistemlerinin kullanımı konusunda önemli araştırmalar yapılmış ve yeni aşıların immünojenikliğini artırabilen adjuvanlar geliştirilebileceği düşünülmüştür 63,64. Bu sistemler, potansiyel olarak bazı yollarla immünojenikliği artırabilir. İlk olarak, birçok nanoparçacık, patojenle ilişkili moleküler kalıpları taklit edebilir, model-tanıma reseptörleriyle doğuştan gelen bağışıklık tepkisini harekete geçirebilir 64. İkincisi, nanoparçacıklara benzer olarak lipozomlar antijen sunan hücreler tarafından alınmakta ve bu da arttırılmış T hücresi aktivasyonuna neden olmaktadır 65.
DNA ile bağlanma ve bir bağışıklık tepkisi (immun yanıt) oluşturma yetenekleri gözönüne alındığında özellikle katyonik lipozomlar, güçlü aşı tasarım platformları olarak görev yaparlar 65,66. Ayrıca, bağışıklığın oluşturulmasında, gerçek virüs DNA'sı olmaksızın bazı nanoparçacıklar yüzeylerinde virüs benzeri parçacıklar oluşturularak gerekli bağışıklık uyarımını sağlayabilir 63. Lipozomlar antijen süresinin uzatılmasını sağlayan formülasyonlar gibi hedeflenebilir depo olarak görev yapabilir 66.
Veteriner hekimlikte patojenlere karşı aşılama için lipozomların potansiyel olumlu özelliklerinden dolayı, gıda hayvanlarında lipozom temelli aşılar çok ilgi uyandırmıştır. Kanatlılarda yapılan bir çalışmada, "subunite" aşılar için lipozomların vektör olarak canlılığı gösterilmiştir. Canlı Salmonella enteritidis mücadelesinde, aşılanmış grup immünize edilmemiş kontrol grubuyla karşılaştırıldığında dışkılardaki bakterilerin atılımının önemli derecede azaldığı ve sekumda S. enteritidis kolonizasyonunun yaklaşık % 95'lik bir inhibisyonu olduğu gösterilmiştir. Enteropatojenlerin dışkıyla atılımının, yumurta kontaminasyonunun başlıca nedenlerinden biri olması nedeniyle, bu çalışmanın aynı zamanda gıda güvenliği ve insan sağlığı üzerine de etkileri vardır 67.
Newcastle (ND) gibi bazı hastalıklarda da, kitosan bazlı nanoparçacıklı aşı formülasyonlarının, piyasada bulunan diğer formülasyonlara kıyasla daha yüksek bir etkinlik gösterebileceğine dair kanıtlar da olduğu bildirilmiştir. La Sota aşısı, ND virüsünün lentojenik canlı La Sota suşunu içermekte ve burun içine uygulanabilmektedir. Lipozomal ND aşısının ticari aşıdan daha iyi sonuç vermesinin nedenleri, çalışmada kullanılan lipozomların hücre zarlarıyla kaynaşabilen katyonik lipozomlar ve küçük bireysel parçacık boyutlarına sahip olmalarından dolayıdır 68.
3.1.5. İlaç ve Gen Veriminde Nanoparçacıklar
Nanoparçacıkların ilaç verme sistemleri olarak yoğun şekilde ilgi görmelerinin nedenleri küçük boyutları ve kan beyin bariyeri gibi biyolojik bariyerleri geçebilmeleridir. Ayrıca, nanoparçacıkların yüksek yüzey alanı/hacim oranı sağlamaları diğer konjugeler ve bileşiklerle reaktivite artışı sağlar. PLGA, polilaktik asit ve poliglikolik asitten oluşan bir kopolimerdir. Amerikan Gıda ve İlaç Dairesi (FDA) tarafından biyolojik olarak uyumlu, parçalanabilir ve toksik olmadığı onaylanan PLGAnın birçok araştırıcı tarafından ilaç taşıyıcı olarak kullanılmasının fizibilitesini araştırılmıştır 69,70.
3.1.6. Diğer Bazı İlaçlarda Lipozomlar
Araştırmacılar, ilaçların ve diğer bazı maddelerin hücre zarıyla etkileşim mekanizmasını incelemek için lipozomları model zar olarak kullanmışlardır. Hücre zarının fosfolipid tabakasına Vitamin K1in etkilerine yönelik araştırmada, DMPC (dimyristoylphosphatidyl-choline) ve DEPE (dielaidoylphosphatidyl-ethanolamine) ile Vitamin K1den oluşmuş bir model zar yapısı kullanılmıştır. Vitamin K1in 25ºCde model zara ilavesiyle DMPCnin interlaminar boşluklarda artış oluşturduğu ve Vitamin K1in DMPC sistemlerinde dairesel yapıyı bozarak, altıgen yapı oluşmasına sebep olduğu gösterilmiştir 71.
Lipozomlar tedavi edici uygulamalara ek olarak bir başka kullanım alanı da hayvanlarda beslenme takviyesidir. Postpubertal ineklerde yapılan bir çalışmada, lipozom kapsüllü α-tokoferol ağız yoluyla uygulandığında, diğer formülasyonlara göre daha yüksek plazma konsantrasyonu oluşturduğu ortaya konmuş ve gelecekte hayvan hastalıklarının önlenmesinde immun sistemini arttırıcı eser mineral ve vitaminlerin lipozom kapsüllü şekilde verilmesinin faydalı olacağı düşüncesi ortaya çıkmıştır 72.
3.2. Balıklarda Nanoparçacık Uygulamaları
Su ürünleri yetiştiriciliğinde antibiyotiklere karşı mikrobiyal dirençle mücadele için alternatif antimikrobiyaller olarak nanoparçacıkların kullanımı araştırılmıştır 73,74. Balıklarda kitosan ve PLGA nanoparçacıkları ilaç uygulanmasında en çok araştırılanlardır 75-77.
Gökkuşağı alabalığı (Oncorhynchus mykiss)da C vitamini kullanımına yönelik yapılan bir araştırmada kitosan nanoparçacıkları ile konjuge edilip incelenmiştir. Vitamin Cnin oral uygulamadan 48 saat sonra serbest kaldığı, kitosan ve vitamin C arasındaki güçlü sinerjizmadan dolayı doğal bağışıklığın uyarıldığı gözlenmiştir 78. Zebra balık embriyoları üzerine yapılan çalışmada 79, PLGA nanoparçacıklarına anti-mikobakteriyel ajan rifampisin yüklenmiş ve daha sonra enjekte edilmiştir. Tek başına rifampisin ile karşılaştırıldığında rifampisin-PLGA nanoparçacıkların M. marinum'a karşı etkisi artmış ve embriyoların daha fazla süre hayatta kaldıklarını gösterilmiştir.
Oral DNA aşısı, Vibrio parahemolyticus'un dış zar proteini K (ompK) genini kitosan nanoparçacıklarına yükleyerek geliştirilmiştir. Bu rekombinant nanoaşı, siyah çipura (Acanthopagrus schlegelii)'da Vibrio parahemolitikusa karşı koruyucu bir bağışıklık tepkisi oluşturmuştur 80. Asya levrekte (Lates calcarifer) Vibrio anguillarum'a karşı oral DNA aşısı, kitosan ve kitosan/tripoly fosfat nanoparçacıkları kullanılarak geliştirilmiştir. Nanoaşının, patojene karşı sadece orta düzeyde koruma sağladığı bildirilmiştir 81.
3.3. Lipozomların Biyomühendislik
Alanında Kullanımı
Kanser olayları ve kalıtsal hastalıkların tedavisinde, gen teknolojilerinin gelişmesi ve gen tanımlanmasıyla önemli gelişmeler olmuştur. Hastalığa sebep olan hasarlı gen yerine sağlıklı gen kopyalarının hücreye yerleştirilmesiyle genetik yapının düzeltilmesi gen tedavisinde temel amaçtır 82.
Gen tedavisinde, kalıtsal hastalık geninin, hedef hücrelerin kesin olarak belirlenmesi, sağlıklı genin kopyalanması hedef hücrelere ulaştırılması temel basamaklardır. Bu basamaklardaki en önemli aşama, etkin bir şekilde gen aktarımı yapılmasıdır. Hücrelere ve bölgelere genleri taşımada fiziksel yöntemler kullanılır. Bunlar, doğrudan DNA ve balistik gen enjeksiyonu ile lipozom formülasyonlardır. Doğrudan DNA enjeksiyonunda DNAyı taşıyan plazmid kas içine verilir. Bu tipi klasik uygulamalarda taşıyıcı olarak lipozomlar kullanılır ve negatif yük içeren DNA molekülleri ile etkileşimi önlemede negatif yüklü LUVlar kullanılır. Bunların yanında, kolesterol kullanılarak toksisitesi azaltılmış ve taşıma kapasitesi arttırılmış pozitif yüklü lipozomlar vardır 83.
4. SONUÇ
İlk defa 1960lı yıllarda tanımlanan lipozomların, yapılarının hücre zarına benzemesi, toksik olmaması, içerik ve yapısının istenilen şekilde hazırlanabilmesi ve istenilen hücreleri hedef alan etkili maddenin kontrollü salınımını sağlayabilme özellikleri diğer kontrollü serbestleştiren sistemlere göre üstünlükleridir. Bu özellikler sayesinde lipozomlardan tıp ve veteriner hekimliği, biyomühendislik, gıda sanayiisi ve kozmetik gibi birçok alanda çeşitli amaçlarla yararlanılmaktadır. Özellikle tıp ve veteriner hekimliği alanında lipozomlanmış ilaçlar kullanıldığında; çok düşük dozda farmakolojik etki sağlanmakta, hastanın sık ilaç alma ihtiyacı, ilacın yan etkileri, toksisitesi ve alerjik etkileri azalmakta, ilacın istenilen sürede serbestleşmesi sağlanmaktadır. Ancak lipozomal ilaç şekillerinin; üretiminin maliyetli olması, hatalı üretimden kaynaklanabilecek doz hataları, fiziksel ve kimyasal dayanıklılık sorunları ile uygulama yollarının farklılığına göre dozun tam tespit edilememesi gibi faktörler kullanımını sınırlamaktadır. Bilim ve teknolojide meydana gelen gelişme ve ilerlemelerle, bu kısıtlamaların ortadan kaldırılacağı ve lipozomların daha fazla önem kazanacağı düşünülmektedir.