Diyabetes mellitus, pankreas beta hücrelerinin fonksiyon kaybı sonucu oluşan hiperglisemi ile karakterize; karbonhidrat, protein ve lipid metabolizmasının bozukluğu ile seyreden metabolik bir hastalıktır
33. Hayvan kanser modellerinin kullanıldığı deneysel çalışmalarda, bazı monoterpenlerin antikarsinojenik, antioksidan, kemoterapötik ve kemopreventif özelliklere sahip olduğu gösterilmiştir
13. Bu çalışmada streptozotosin ile diyabet oluşturulmuş ratlarda oksidan/antioksidan parametreler ve apoptotik markerlar araştırılarak perilil alkolün koruyucu etkinliği araştırılmıştır.
Çalışmalarda deneysel diyabet modeli oluşturmak amacıyla birçok yöntem (cerrahi, farmakolojik, genetik) deney hayvanlarında uygulanmaktadır. Bunlardan en yaygını ise Streptozotosin (STZ) uygulamasıdır. Streptozotosinin pankreasın β hücrelerinde hasara neden olarak hiperglisemi oluşturmaktadır 34. Motawi ve ark. 35 streptozotosin ile indüklenen diyabetin hiperglisemiye neden olduğunu ve böbrek fonksiyonlarını bozduğunu bildirmişlerdir. Bu çalışmada benzer şekilde tek doz STZ (50 mg/kg; ip) uygulandıktan 3 gün sonra kan glikoz değerleri 270 mg/dL üzerine çıktığı tespit edilmiştir.
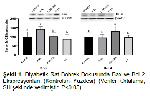
Hiperglisemi, dokularda ROS üretimini artırarak oksidatif strese neden olmaktadır. Diyabette, oksidatif stres ROSun artmasından kaynaklanabileceği gibi CAT ve GSH-Px gibi antioksidan enzim aktivitelerinin azalmasından da kaynaklanabilmektedir 36. Hücrede lipid peroksidasyonun artışı sonucu MDA düzeyinde bir artış olmaktadır. Hücrede lipid peroksidasyonunun artması, membran permeabilitesinde bozukluklara ve hasara neden olarak birçok patolojik olgunun oluşmasına zemin hazırlamaktadır 37. Bu çalışmada diyabet grubu kontrol grubuyla kıyaslandığında, böbrek dokusu MDA düzeyinde bir artış görülmüş olup, Obrosova ve ark. 38 ve Kataya ve ark. 39nın yaptığı çalışmaların bulgularıyla paralellik göstermektedir. Yixiao ve ark. 40 hipoksi-reoksijenasyon hasarı oluşturulmuş böbrek hücrelerinde in vitro olarak yaptıkları çalışmalarında PA uygulamasının MDA düzeyini düşürerek oksidatif hasarı azalttığını göstermişlerdir. Bu çalışmayla, Perilil Alkolün böbrek hipoksi-reoksijenasyon tedavisinde potansiyel bir terapötik madde olarak kullanılabileceğine dair kanıtlar sunmaktadırlar 40. Bu çalışmada ise D.M+P.A grubunda D.M grubuna göre MDA düzeyinin önemli ölçüde azaldığı (P<0.01) ve bunun Yixiao Xua ve ark. 40nın yaptıkları çalışma ile benzerlik gösterdiği görülmüştür.
Hiperglisemi dokularda oksidatif hasara yol açmaktadır. Diyabetli canlılarda artan glikozun otooksidasyonu sonucu hidrojen peroksit (H2O2) miktarının arttığı ve bunun sonucu olarak katalaz aktivitesinin azaldığı düşünülmektedir 41. Bu çalışmada D.M grubu kontrol grubuyla kıyaslandığında katalaz aktivitesinde önemli bir azalış (P<0.05) tespit edilmiş olup daha önce yapılan çalışmalarla benzerlik göstermektedir 42. Khan ve ark. 16 hepatik oksidatif stres oluşturdukları ratlarda, koruyucu olarak farklı dozlarda PA uygulamışlar ve bunun katalaz aktivitesinde azalmayı engellediğini göstermişlerdir. Bu çalışmada diyabet grubunda kontrol grubuna göre azalma gösteren CAT aktivitesinin D.M+P.A grubunda ise kontrol grubuyla aynı seviyelerde olduğu görülmüş olup bu durumun Khan ve ark. 16 yaptığı çalışmayla benzediği görülmüştür. Daha önce yapılan bir çalışmada deneysel diyabet oluşturulan ratlarda indirgenmiş GSH düzeyi ve GSH-Px aktivitesinin azaldığı gösterilmiştir 42,43. Bu çalışmada kontrol grubuyla karşılaştığında diyabet grubundaki GSH düzeyi ve GSH-Px aktivitesinin önemli ölçüde azaldığı görülmüş olup litaratürde yer alan bilgilerle benzerlik göstermektedir. Diyabet grubuyla karşılaştırıldığında ise D.M+P.A grubundaki GSH düzeyi ve GSH-Px aktivitesinin diyabet grubundaki gibi önemli şekilde azalmadığı görülmektedir. Jahangir ve ark. 45 ferrik nitrilotriasetat (Fe-NTA) ile nefrotoksisite oluşturdukları ratlarda farklı dozlarda perilil alkol uygulamasının GSH düzeyinde azalmayı önlediğini belirtmektedirler. Bu çalışmada D.M+P.A grubunda GSH düzeylerinin azalmamış olması Jahangir ve ark. 45 yaptığı çalışmayla benzerlik göstermektedir. Khan ve ark. 16 hepatik oksidatif stres oluşturdukları ratlarda, koruyucu olarak farklı dozlarda P.A uygulanmasının GSH-Px aktivitesindeki azalığı engellediğini göstermekte olup; bu çalışmanın sonuçları ile paralellik göstermektedir.
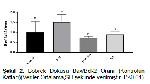
Hücrelerde apoptosisi indükleyen birçok uyarıcı vardır. Hücrelerin bu uyaranlara duyarlılığı proapoptotik ve antiapoptik proteinlerin eksprasyonu ve uyaranın derecesine göre değişiklik gösterir. Bazı durumlarda oksidatif stres gibi hücresel stresi takiben açığa çıkan intrinksik faktörler apoptosis başlatır. İntrinsik sinyaller sonucu başlayan apoptosis genel olarak mitokondrideki sitokrom c ve kardiyolipinin etkileşimi sonucu gerçekleştirir. Apoptozisin düzenlenmesinde yer alan Bcl-2 ailesinin antiapoptik üyeleri mitokondri membranının dış kısmında yer alırlar ve hücrenin yaşamını devam ettirmesini sağlarlar. Bax gibi Bcl-2 ailesinin proapoptik üyeleri ise mitokondri membranı ile direkt ilişki kurarak mitokondri üzerinden etkilerini gösterirler 10. Deneysel böbrek hasarı oluşturulmuş yuratlarda Bax protein ekspresyonunun arttığı, buna karşın Bcl-2 protein ekspresyon düzeyinin ise azaldığı tespit edilmiştir 45,46. Diyabetes mellitusun en önemli komplikasyonlarından biri olan diyabetik nefropatide de böbrek dokusunda Bax protein ekspresyon düzeyinin arttığı buna karşın Bcl-2 protein ekspresyon düzeyinin azaldığı tespit edilmiştir 47,48. Yapılan başka çalışmalarda ise, kan şekeri seviyesindeki düzensizliklerin glomerüler mezenşiyal hücreleri 49, vasküler endotel hücreleri 50 ve insülin salgılayan hücre dizilerinde (INS-1 hücreleri) 51 apoptozu tetikleyen etkileri olduğunu gösterilmiştir. diabetes mellitusun erken evresinde Diyabetik nefropatiye sebep olacak apoptotik değişiklikler konusunda yapılan çalışmalar, oldukça kısıtlıdır. Kikuch ve ark. 10nın ratlarda yaptıkları bir çalışmada, diyabetin erken döneminde, apoptozisle bağlantılı Bcl-2 ve Bax proteinlerinin ekspresyon düzeyleri, nefron segmentlerinde histolojik olarak araştırılmıştır. Kontrol grubundakilerle kıyaslandığında Diyabetik ratların, proksimal tübüllerde ve henle kulpunun kalın kolundaki Bax protein ekspresyonunun arttığını göstermişlerdir. Aynı çalışmada diyabetik ratlardaki Bcl-2 protein ekspresyon düzeyinin proksimal tübüllerde azaldığını, henle kulpunun kalın kolunda ise de arttığını göstermişlerdir. Aynı zamanda diyabetik sıçanların proksimal tübüllerindeki Bcl-2 protein ekspresyonunun Bax protein ekspresyonuna oranı (Bcl-2/Bax) önemli ölçüde azaldığını tespit etmişlerdir. Aksine kontrol grubundakilerle kıyaslandığında diyabetik sıçanlardaki Bcl-2/Bax protein ekspresyonu oranının, henle kulpunun kalın kolunda belirgin şekilde yükseldiğini tespit etmişlerdir. Kikuch ve ark. 10nın yaptıkları bu çalışmanın sonunda, diyabetin erken dönemlerindeki yüksek glukoz değerlerinin proksimal tübüllerde apoptotik değişikliklere neden olabileceği; ancak bu durumun glomeruller ve distal tubularda apoptik süreci etkilemeyeceği ifade etmektedir. Bu çalışmada böbrek dokusundaki Bax ile Bcl-2 protein sentez düzeyleri western blot tekniği ile ölçülmüştür. Kontrol grubuyla kıyaslandığında diyabetik ratların böbrek dokusunda, Bax protein düzeyinin arttığı, Bcl-2 protein düzeyinin azaldığı ve Bax/Bcl-2 protein ekspresyon oranının ise arttığı tespit edilmiş ve yukardaki çalışmayla 10 benzediği görülmüştür. Son zamanlarda Yixiao ve ark. 40nın in vitro olarak yaptıkları çalışmalarında, P.A uygulamasının hipoksi/reoksijenasyon hasarı oluşturulmuş böbrek tubül epitel hücrelerinde Bax protein ekspresyonunu azalttığı, Bcl-2 protein ekspresyon düzeyini ise arttırdığını tespit etmişlerdir. Bu çalışmada benzer şekilde diyabet grubunda Bax ekspresyon düzeyinin arttığı buna karşın Perilil alkol ile tedavi grubunda Bax ekspresyon düzeyi azalırken Bcl-2 protein ekspresyon düzeyinin arttığı görüldü. Ayrıca Bax/Bcl-2 protein ekspresyon oranının ise önemli ölçüde azaldığı tespit edilmiştir.
Sonuç olarak, diyabetik ratların böbrek dokusunda artan MDA ve Bax protein düzeylerinin doku hasarı ile ilişki olduğu; perilil alkolün antioksidan ve antiapoptotik etkileri sonucu böbrek dokusundaki oksidatif hasarı ve apoptozisi azaltarak diyabetin olumsuz etkilerini azaltabileceği düşünülmektedir. Fakat perilil alkolün antioksidan ve apoptotik özelliklerinin daha iyi anlaşılması ve terapötik dozunun belirlenmesi için daha detaylı çalışmalara ihtiyaç duyulmaktadır.