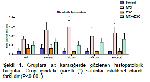
MTX kullanımının karaciğer ve böbrek üzerindeki
olumsuz etkilerinin dokularda sebep olduğu oksidatif
stres artışından kaynaklanabileceği ifade edilmektedir
4-7,29. Doza ve uygulama süresine bağlı olarak MTX
kullanımının karaciğerde yağlı değişikliklerden siroza
varan değişikliklere neden olabileceği belirtilmektedir
2,4,6 10,11,30. Bu çalışmada MTXin karaciğerde
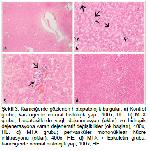
mononüklear hücre infiltrasyonu ve hidropik
dejenerasyon gibi değişikliklere neden olduğu tespit
edildi. Eskuletin uygulamasının MTXin karaciğer
dokusunda sebep olduğu bu yangısal ve dejeneratif
değişiklikleri önemli derecede azalttığı ve karaciğerde
koruyucu etki gösterdiği belirlendi. Lin ve ark.
31
eskuletinin karaciğerde oksidatif stresi baskıladığını;
lökosit infiltrasyonu ve hepatosit dejenerasyonunu
azalttığını saptamışlardır.
Karaciğer fonksiyonlarında görülen bozukluk MTX
tedavisinde görülen en önemli komplikasyonlardan
birisidir 32. AST, ALT gibi enzimler, karaciğer hasarının
hassas belirteçleridir ve dolaşımdaki seviyelerinin
tahmini, hepatoselüler hasarı belirtmek için yararlı bir
nicel belirteçtir 33,34. Yapılan bilimsel çalışmalarda
33,34,35 MTX uygulamasının karaciğer
fonksiyonlarının belirteci olan karaciğer enzim
aktivitelerinde artışlara yol açtığı bildirilmektedir. Yapılan
çalışmada da MTX uygulaması serum AST ve ALT
seviyelerini yükseltti. MTXin sebep olduğu karaciğer hasarının mekanizmasında intrasellüler MTX-PGs birikimi ve folat azalmasının sorumlu olabileceği düşünülmektedir 36. MTX uygulaması, sıçan karaciğerinde artan lipid peroksidasyonu ve NO seviyeleri ile gösterildiği gibi hem oksidatif hem de nitrozatif stresleri indüklemiştir. MTX uygulaması, rat karaciğerinde artan lipid peroksidasyonu sonucu oksidatif stresi indüklemektedir. Oksidatif stres kaynaklı hücre hasarı, birçok akut ve kronik hastalığın patogenezinde önemli bir faktördür 37. Bu çalışmada da MTX uygulamasının karaciğer dokusu MDA düzeylerini önemli derecede arttırdığı tespit edildi. MTX'in mitokondriyal enzimatik ve enzimatik olmayan antioksidan mekanizmanın tükenmesi yoluyla karaciğer mitokondriyal hasarına dolaylı olarak etki ettiği bildirilmektedir 38 Mitokondri, oksidatif stres için birincil hücre içi hedeftir ve mitokondri hasar gördüğünde mitokondriyal ROS/RNS üretimi önemli ölçüde artarak oksidatif hasarı indükler 39 MTX ile indüklenen oksidatif stres, azalan GSH ve antioksidan enzimler GSH-Px ve CAT aktiviteleri ile daha da doğrulanmış oldu. Bu veriler önceki çalışmalarla benzerlik göstermektedir 35. Bu antioksidan savunmalar, oksidatif stres ve inflamasyona karşı korumada merkezi bir rol oynar 40.
Yapılan çalışmalarda 31,41-43 deneysel karaciğer hasarında eskuletin uygulamasının MDA düzeylerini düşürdüğü, karaciğer dokusu GSH düzeyini arttırdığı ve bu suretle oksidatif stresi baskıladığı bildirilmektedir. Bu çalışmada MTX+Eskuletin grubunda serum AST ve ALT düzeyleri ile karaciğer dokusu MDA düzeylerinde azalma olduğu, karaciğer dokusu GSH düzeyi ile GSH-Px enzim aktivitesinde önemli düzeylerde artışların görüldüğü tespit edildi. Elde edilen bulgular eskuletinin serbest radikal süpürücü ve antioksidan etkilerinden kaynaklı olabileceğini göstermektedir.
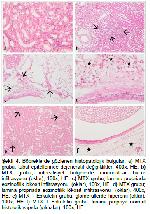
Deneysel çalışmalarda 5,12,44,45 MTXin böbrek dokusunda yangısal hücre infiltrasyonu, glomeruloskleroz ve tubul hücrelerinde dejenerasyondan nekroza varan histopatolojik değişikliklere sebep olduğu belirtilmektedir. Yapılan çalışmada MTX uygulamasının böbrek tubul epitellerinde dejenerasyona ve mononüklear hücre infiltasyonuna neden olduğu belirlendi. Ancak bu çalışmada ilk defa MTXin pelvis renaliste eozinofilik lökosit infiltrasyonuna neden olduğu gözlendi. Eozinofil lökosit infiltrasyonu ilaç reaksiyonlarında, özellikle antibiyotiklere bağlı olanlarda gözlenen bir durumdur 46. MTX, eskuletin ile birlikte uygulandığında ise böbrek dokularında sadece hafif parankim dejenerasyonu ve mononüklear hücre infiltasyonu saptandı. Pelvis renaliste ise eozinofilik lökosit infiltrasyonuna rastlanmadı. Parabakaran ve ark. 47 eskuletininin karaciğer ve böbrek dokusunda antioksidan ve antiinflamatuvar etkiye sahip olduğunu belirtmektedirler. Yapılan çalışmada da eskuletinin mononüklear hücre infiltrasyonunu ve dejenerasyonu azalttığı tespit edildi. Ayrıca eozinofil lökosit infiltrasyonunu tamamen önlediği saptandı.
Yüksek ROS ürünleri daha önce farklı kemoterapötik kaynaklı nefrotoksisitede rapor edilmiştir. MTX'in ROS ürünlerinin seviyelerini doğrudan arttırmasından kaynaklanan zararlı etkisi hücresel işlev bozukluğuna neden olabilir. Aşırı ROS üretimi, oksijen kaynaklı serbest radikallerin seviyelerini artırarak hücresel hasarı tetikleyebilir 48. Yapılan çalışmalarda 44,45 MTX uygulamasının ROS artışını tetikleyerek böbrek dokusu MDA düzeylerini arttırdığı, böbrek dokusu GSH düzeyi ve SOD, CAT ve GSH-Px gibi enzim aktivitelerinde ise azalmaya neden olduğu bildirilmektedir. Bu çalışmada da MTX uygulamasının böbrek dokusu MDA düzeyini arttırdığı, GSH-Px ve CAT enzim aktivitelerini ise istatistiki açıdan anlamlı derecede düşürdüğü gözlendi. Eskuletin tedavisinin ise böbrek dokusu MDA düzeyini kontrol grubuna yakın değerlere indirdiği tespit edildi. Ayrıca GSH-Px ve CAT enzim aktivitelerinde artışa neden olduğu belirlendi. Eskuletinin antioksidan özelliğinin bu etkileri gösterdiği söylenebilir.
Sonuç olarak, eskuletin uygulamasının MTXin karaciğer ve böbrek dokusunda meydana getirdiği hasara karşı koruyucu etki gösterdiği tespit edildi.