İnsektisitler, dünya genelinde tarım ve hayvancılıkta genellikle haşerelerden kurtulmak, istenmeyen böceklerin çoğalmasını engellemek ya da kontrol altına almak için kullanılan, yüksek dozları solunum ve sinir hasarları gibi ciddi ölümcül rahatsızlıklara yol açabilecek maddelerdir
22. Bu maddeler böceklerle ve sineklerle mücadelede kullanımının birçok yararlı etkilerinin yanı sıra, bilinçsiz kullanımı sonucu çevreye yayılmakta ve aşırı maruziyeti sonucu insan ve hayvan sağlığı adına ciddi toksik etkilere de sebep olabilmektedirler
23. Diğer yandan doğal ürünlerden elde edilen bileşiklerin günümüzde birçok toksik etkenlere karşı faydalı etkileri araştırılmakta ve elde edilen sonuçlar bu bileşiklerin anti-inflamatuar, anti-otofajik, anti-apoptotik gibi önemli yararlarının olduğunu göstermektedir. Sunulan çalışma DLM kaynaklı oluşan mide hasarı ve toksisitesine karşı RUTun etkilerini incelemek amacıyla gerçekleştirildi.
Reaktif oksijen türleri birçok eksojen ilaç, toksik etkenler ve ksenobiyotiklere maruz kalma sonucu oluşan serbest radikallerdir 24-26. Oksidatif stres, ROSların seviyelerinde artış veya antioksidan seviyelerinde bir azalmanın sonucu olarak meydana gelir 27. Oksidan türlerin seviyesi antioksidan seviyelerini aştığında, bir diğer deyişle antioksidan-oksidan dengenin bozulup dengenin oksidan tarafa kaymasıyla redoks homeostazı bozulmakta ve bu da oksidatif strese neden olmaktadır 28. Normal sinyal iletim süreçleri için düşük konsantrasyonlarda oksidan türlere ihtiyaç duyulsa da bu maddelerin yüksek seviyelerinin birçok patolojik duruma yol açtığı bildirilmiştir 29.
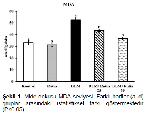
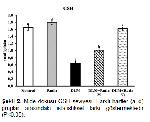
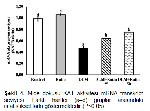
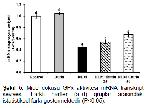
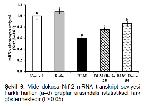
Reaktif oksijen türlerine karşı oluşabilecek hasarı önlemede ilk savunma hattını SOD, KAT ve GPx gibi enzimler oluştururlar. SOD, süperoksit radikalinin normal moleküler oksijen ve hidrojen peroksite dönüştürülmesinin katalize edilmesinde görev alırken, hücreler için oldukça toksik ve geri dönüşümsüz hasarlara sebep olabilen bir bileşik olan hidrojen peroksit KAT ve GPx tarafından su ve moleküler oksijene parçalanmaktadır 30. GSH, ROSlara karşı ikinci savunma hattını oluşturan, hücreleri serbest radikaller, peroksitler ve ağır metaller gibi ROSların toksik etkilerinden koruyan nonenzimatik yapıda bir antioksidandır 31. GSH, serbest radikalleri bağlayarak oksitlenmiş (GSSG) forma dönüşebilmektedir ve GSSG-GSH oranı oksidatif stresin önemli bir ölçüsüdür 32. MDA önemli bir hücre hasarı belirteci olmasının yanısıra membrandaki lipitlerin başlıca oksidatif hasar göstergesidir 33,34. Küçükler ve ark. 11, DLM toksisitesinin en önemli nedeninin oksidatif stres artışı olduğunu ifade etmiş, ratlar üzerinde yaptıkları çalışmada DLMnin lipit peroksidasyonu artırırken antioksidan enzim aktivitelerinde azalmaya neden olduğunu bildirmişlerdir. Sunulan çalışmada da DLMnin mide dokularında SOD, KAT ve GPx enzim aktiviteleri ile MDA seviyeleri arasında ters korelasyona neden olduğu ve oksidatif hasarı artırdığı tespit edilmiştir. Bununla birlikte RUTun serbest radikalleri süpürücü özellik göstererek oksidan-antioksidan dengenin bozulmasını önlediği, antioksidan enzim aktivitelerinin artmasını ve GSH depolarının yenilenmesini sağlayarak MDA seviyelerinde azalmaya neden olduğu belirlendi.
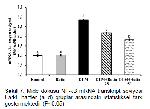
Nükleer faktör (eritroid kaynaklı 2)-related factor 2, inflamasyon durumunda aktive olan, oksidatif hasara karşı korumada, oksidan-antioksidan dengeyi düzenlemede önemli role sahip temel bir lösin fermuar (bZIP) proteinidir 32,35. Sitoplazmada bir hücre iskeleti proteini olan Keap1 tarafından bastırılır ve serbest radikaller tarafından uyarıldığında Keap1den ayrılarak aktive olur 36. Aktive olmuş Nrf-2 çekirdeğe girer ve HO-1 ve NQO1 gibi antioksidan enzimlerin ekspresyonunu faz II savunma enzimleri ile birlikte düzenler 37. Celik ve ark. 38 ratlar üzerinde yaptıkları bir çalışmada, RUTun Nrf-2 yolunu aktive ederek oksidatif stresin neden olduğu hücresel hasarı azalttığını bildirmişlerdir. Mevcut çalışmada da, DLM kaynaklı artan inflamasyon sonucu Nrf-2 ekspresyonunda düşüş meydana geldiği, RUTun Nrf-2 ekspresyonunu önemli ölçüde artırdığı tespit edilmiştir.
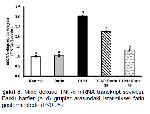
Bir transkripsiyon faktörü olan NF-κB, proinflamatuar sitokinlerin aktivasyonunda önemli bir rol oynamaktadır ve birçok dokuda immün yanıtın aktive edilmesinden sorumludur 4,16. Ayrıca NF-κBnin, Nrf-2 ekspresyonunu baskıladığı ve antioksidan özelliklerini azalttığı bildirilmiştir 39. Farklı bir çalışmada, DLMnin NF-κB aktivasyonuna neden olarak dokularda inflamasyona sebep olduğu rapor edilmiştir 40. Caglayan ve ark. 41 da RUTun antioksidan özelliklerinden dolayı ROSu temizlediği ve böylece NF-κB transkript seviyelerini önemli ölçüde azalttığını göstermiştir. Sunulan çalışmada da DLMin mide dokularında NF-κB transkript seviyelerini artırdığı ve bunun sonucunda Nrf-2 supresyonu yoluyla hem oksidatif strese hem de mide hasarına neden olduğu, DLM ile birlikte uygulanan RUT tedavisinin ise NF-κB transkript düzeylerini ve mide toksisitesini azalttığı belirlendi. Nükleer faktör kappa Bnin aktivasyonunu sağladığı TNF-α, inflamasyonda görevli önemli bir pro-inflamatuar sitokindir 40. Mide toksisitesi durumunda TNF-α seviyelerinin yükseldiği daha önce yapılan çalışmalarla gösterilmiştir 42,43. Saklani ve ark. 44 tarafından yapılan çalışmada artan TNF-α seviyelerinin RUT uygulaması sonucunda azaldığı bildirilmiştir. Sunulan çalışmada TNF-α transkript seviyelerinde artış tespit edilmiş ve bunun muhtemel sebebinin DLM kaynaklı oluşabilecek ROS üretimine bağlı NF-κB aktivasyonunun TNF-α gen ekspresyonlarını upregüle etmesi sonucu olduğu düşünülmüştür.
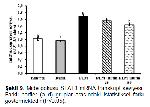
Apoptoz, çeşitli patolojik ve fizyolojik uyaranlar tarafından yönlendirilen, normal ve programlı bir hücre ölümü sürecidir 45. Kaspaz-3 adı verilen proteolitik enzim, apoptoz sürecinin önemli faktörlerindendir ve kaspaz-3 ekspresyonunun aktivasyonu dokularda hasarın önemli bir kanıtıdır. STAT3 sinyal yolu, kaspaz-3 gibi apoptozda görev alan, doku hasarı ve toksisite hakkında önemli bir belirteç olan transkripsiyon faktörüdür 25. Tamamen aktive olan STAT3, anti-apoptotik (Bcl-XL) 46,47 ve proliferasyon düzenleyici proteinlerin (cyclin D1 and Myc) 48,49 gen transkripsiyonunu düzenlemektedir. Yapılan bir çalışmada 1 DLM uygulanan ratlarda kaspaz-3 ve STAT3 ekspresyonunun artarak ratlarda apoptozun ciddi anlamda şekillendiği gösterilmiştir. RUT uygulamasının ise apoptotik genlerin ekspresyonlarını suprese ederek hücrelerin apoptoza karşı önemli derecede bir savunma kazanmasını sağladığı bildirilmiştir 30,50. Sunulan çalışmada mide dokularında kaspaz-3 ve STAT3 mRNA transkript seviyeleri değerlendirildiğinde, apoptozu tetiklediği tespit edildi. Bununla beraber RUTun antioksidan özelliğine bağlı olarak kaspaz-3 ve STAT3 ekspresyonlarını baskıladığı saptanmıştır.
Sonuç olarak, RUTun DLM kaynaklı oluşan mide toksisitesinde antioksidan, anti-inflamatuar ve anti-apoptotik etki göstererek ROS oluşumunu azalttığı ve mide dokusunda meydana gelen hasarı hafiflettiği tespit edilmiştir. Bu nedenle sunulan çalışmada elde edilen veriler, DLM kaynaklı mide toksisitesinde RUTun kullanılabilirliği ve alternatif tedavi yöntemleri arasında yer almasına yönelik yapılacak diğer çalışmalara destek olacak niteliktedir.