Araştırma ve Yayın Etiği: Fırat Üniversitesi Hayvan Deneyleri Etik Kurulundan (FÜHADEK), onay alındıktan sonra (Tarih: 20.01.2011, Toplantı: 2011/1, Karar No: 21), çalışma standart deneysel hayvan çalışmaları etik kurallarına uygun olarak yapıldı.
Hayvanlar ve Deneme Düzeni: Çalışmada Fırat Üniversitesi Deneysel Araştırma Merkezinden (FÜDAM) temin edilen ve ağırlıkları 210±5 g arasında değişen erkek Wistar albino cinsi ratlar kullanıldı (n=40, 8 haftalık). Deney hayvanlarının bulundukları nisbi nem %55 ±5, ortam sıcaklığı 22±2 ˚C ve 12 saat aydınlık, 12 saat karanlık olacak şekilde takip edildi. Hayvanlara yem ve su ad libitum olarak verildi.
Nefrotoksisite tek doz intraperitoneal (i.p.) sisplatin enjeksiyonu ile oluşturuldu. Sisplatin (Sigma Chemical Co, USA), %0.9 salin (1 mL/100 gr/kg i.p.) içinde 7 mg/kg olacak şekilde i.p. enjeksiyon yoluyla araştırmanın 3. gününde tek dozda uygulandı.
Ratlar rastgele aşağıdaki şekilde gruplandırıldı:
1. Kontrol grubu (n=10): Sisplatin uygulanmayan, araştırmanın 3. gününde i.p. olarak sisplatinle eşit hacimde izotonik salin solüsyonu (1 mL/kg/gün) uygulanan ve bazal diyetle beslenen ratlar.
2. Melatonin grubu (n=10): Sisplatin uygulanmayan, 12 gün süreyle Melatonin (Sigma-Aldrich, St Louis, MO, USA) (4 mg/kg/gün) verilen ratlar.
3. Sisplatin grubu (n=10): Sisplatinin araştırmanın 3. gününde %0.9 salin içinde 7 mg/kg olacak şekilde i.p. enjeksiyon yoluyla tek dozda uygulandığı ratlar.
4. Melatonin+Sisplatin grubu (n=10): Sisplatin uygulanan ve uygulamadan 2 gün önce ve uygulamadan sonra 10 gün süreyle Melatonin (4 mg/kg/gün) verilen ratlar.
Melatonin, her bir rata 4 mg/kg/gün dozunda karanlık periyoda geçmeden hemen önce i.p. enjeksiyonla sisplatin uygulamasından 2 gün önce ve uygulamadan sonra 10 gün toplam 12 gün süreyle günde 1 kez olacak şekilde verildi. Sisplatin uygulamasından 10 gün sonra ratlar anestezi altında dekapite edilerek analizler için doku örnekleri alındı ve analizler yapılıncaya kadar -80 ˚Cde saklandı. Böbrekler histolojik inceleme için hemen %20 nötr tamponlu formalin solüsyonunda sabitlendi. Serum üre-azotu ve kreatinin ölçümleri için kan alındı.
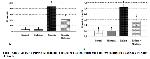
Laboratuvar Analizleri: Kan örnekleri 3000 gde 10 dk süreyle santrifüj edildi ve serumları ayrıldı. Serum üre nitrojeni ve kreatinini biyokimyasal analizör ile (Olympus AU-660, Japonya) ölçüldü. Doku MDA seviyeleri, yüksek basınçlı sıvı kromatografisiyle (HPLC, Shimadzu, Tokyo, Japonya) analiz edildi (35). 8-iso-PGF2α düzeyleri enzyme-linked immunosorbent assay (ELISA) yöntemine göre çalışan ticari kitlerle (Cayman Chemical, MI, USA) ELISA cihazında (Elx800; Bio-Tek Instruments Inc, Vermont) ölçüldü.
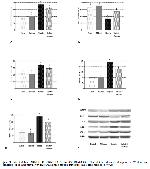
Böbrek dokusu 1:10 (w/v)luk soğuk hipotonik tampon [10 mM HEPES (pH 7.8), 10 mM KCl, 2 mM MgCl2, 1 mM DTT, 0.1 mM EDTA, ve 0.1 mM phenylmethylsulfonyl-fluoride (PMSF)] içinde homojenize edildi. Doku homojenatlarına %10luk Nonidet P-40 (NP-40) çözeltisinden 80 μL ilave edildi ve karışım 14.000 g'de 2 dakika süre ile santrifüj edildi. Süpernatanlar yeni tüplere alındı. Pellet, 40 μL %10luk NP-40 ilaveli soğuk hipotonik tamponun 500 μL'si ile bir kez yıkandı. Daha sonra 200 μL tampon [50 mM HEPES (pH 7.8), 50 mM KCI, 300 mM NaCI, 0.1 mM EDTA, 1 mM DTT, 0.1 mM PMSF,%20 gliserol] içerisinde yeniden süspanse edildi ve 14.800 gde 5 dakika boyunca santrifüj işlemi yapıldı. Elde edilen süpernatant yeni tüplere alındı. Protein konsantrasyonu Lowry prosedürüne uygun şekilde protein ölçüm kiti kullanılarak (Sigma, St. Luis, MO, ABD) ölçüldü. Sodyum dodecyl sülfat-poliakrilamid jel (SDS-PAGE) içinde eşit miktarlarda (50 μg) protein, elektroforez için kullanıldı (36). Arkasından nitrosellülöz membranlara (Schleicher and Schuell Inc, Keene, NH, USA) aktarıldı. Nitrosellülöz membranlar PBS içinde 5 dakika süreyle 2 kez yıkandı ve %1lik sığır serum albümini içerisinde primer antikor uygulamasından önce 1 saat bekletildi. Primer antikor [NAMPT, SIRTUIN-1, COX-2, TGF-β1, TNF-α (Abcam, Cambridge, İngiltere)] %0.05 Tween-20 içeren aynı tampon içinde 1:1000 oranında dilüe edildi. Nitrosellülöz membran gece boyunca 4°Cde primer antikorları ile inkübe edildi. Blotlar yıkandı ve sekonder antikor [horseradish peroksidaz-conjugated goat anti mouse IgG (Abcam, Cambridge, İngiltere)] ile inkübe edildi. Spesifik bağlanma, diaminobenzidin ve H2O2 substratları kullanılarak tespit edildi. Protein yükleme β-aktin antikoruna (A5316; Sigma) karşı monoklonal bir mouse antikoru kullanılarak kontrol edildi. Protein düzeyleri bir görüntü analiz sistemi (Image J; National Institute of Health, Bethesda, USA) ile dansitometrik olarak analiz edildi.
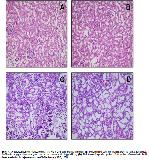
Her bir rattan alınan sol böbrek histolojik inceleme için hemen %20lik nötral tamponlu formalin solüsyonu ile fikse edildi. Daha sonra yavaş yavaş dehidrate edilip parafine gömüldü. Parafin bloklar standart işlemlere uygun olarak 5 µMlik kesitler halinde kesilerek hematoksilen- eosin boyası ile boyandı. Her bir böbrek lamı için minimum 10 alan incelendi. Vaküoler dejenerasyon, tübüler atrofi ve dilatasyon, tübüler nekroz, interstisyel ödem ve inflamasyon semikantitatif olarak değerlendirildi. Değişimin şiddetini belirlemede kullanılan derecelendirme sistemi: (-): yok, (+): hafif derece hasar, (++): orta derece hasar, (+++): şiddetli hasar olarak belirlendi.
Verilerin değerlendirilmesinde SAS (2002) istatistik paket programı kullanıldı 37. Veriler varyans analizi (ANOVA) kullanılarak analiz edildi. Değişkenler ortalama±standart hata olarak gösterildi. Grup içi farklılığı ortaya koymak amacıyla Fisher LSD post hoc testi uygulandı. İstatistiksel anlamlılık P<0.05 olarak kabul edildi.