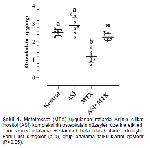Bu çalışma, MTX uygulanan ratlarda ASİnin serum AST, ALT, üre ve kreatin düzeyleri ile kemik dokusu osteokalsin, NF-κB, RANKL, OPG, tip 1 kollajen, IL-1β, IL-6 ve TNF-α protein düzeyleri üzerine olan etkilerini değerlendirmek üzere tasarlanmıştır. Kemoterapi kanser tedavisinde ilk etapta düşünülen tedavi seçeneğidir
34,35. Ancak kemoterapötik ajanlar, kemik dokusunda hasarlara neden olur
11. Deneysel araştırmalar bir kemoterapötik ajan olan MTX kullanımının kemik büyümesini azalttığı ve osteoklast aktivitesini artırdığı bilinmektedir
2,4,8,11. Yan etkilere rağmen, MTX'in yan etkilerini azaltmak için kullanılan spesifik bir tedavi yoktur. Kemoterapötik ajanların yan etkilerinin azaltılması üzerine son yıllarda çok sayıda araştırma yapılmıştır
11,23,36. ASİ kompleksi, arginin, silikon ve inositolün bir karışımıdır. Argininin memelilerde immünolojik fonksiyonlar üzerinde etkili olduğu bildirilmiştir
37. Silikonun çeşitli rolleri, büyük ölçüde deneysel çalışmalara dayalı olarak tanımlanmıştır
38. Doğada bol miktarda bulunan bir eser mineral olan silikonun daha güçlü kemikler ve daha esnek eklemler için gerekli bir bileşen olduğu kanıtlanmıştır
39. Silikonun kemik dokusunda kalsiyum ve fosfor birikimi için düzenleyici bir faktör olarak hareket ettiği sonucuna varılmıştır
39. Son araştırmalar
28,40, diyetteki arginin ve silikonun uzun kemiklerin gelişimi, büyümesi ve modellenmesinde önemli bir rol oynayabileceğini düşündürmektedir. Osteokalsin, osteoblastlar tarafından sentezlenir ve plazma konsantrasyonu, kemik oluşum hızı ile koreledir
41. Yapılan çalışmalarda
17,22,36, osteokalsinin, MTX ile tedavi edilen ratlarda kontrol grubuna kıyasla arttığı görülmüştür. Çalışmada osteokalsin düzeyinin kontrol grubuna göre MTX grubunda bir düşüş gösterdiği, ancak ASİ+MTX grubunda MTX grubuna göre ise artış gösterdiği belirlenmiştir (Şekil
1). MTXin kemoterapötik etkilerinin yanısıra, karaciğer, böbrek ve kemik iliği üzerine ciddi yan etkileri vardır
42. Yapılan çalışmalar
42-44, MTXin serbest oksijen radikallerinin aşırı üretimi sonucunda serum AST ve ALT düzeylerinde artış meydana geldiğini ortaya koymuştur. Çalışmada, MTX uygulanan ratların serum örneklerindeki AST ve ALT aktivitelerinde kontrol grubuna göre artış olduğu görülmüştür. ASİ+MTX grubunda ise AST ve ALT aktivitelerinde azalma görülmüştür (Şekil
2). MTX aracılı nefrotoksisitenin, antioksidan tedaviyle azaldığı bildirilmiştir
45. Çalışmada MTX verilen ratlarda üre ve kreatin seviyelerinin kontrol grubuna göre arttığı ve ASİ+MTX grubunda ise azaldığı tespit edilmiştir (Şekil
2).
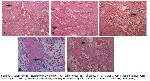
Yapılan bir çalışmada 46 MTX uygulanan ratlarda muhtemel kemik oluşum mekanizmasının, yüksek hidrojen peroksit ve lipit peroksidasyonu ve azaltılmış antioksidan enzim aktiviteleri ile üretilen oksidatif strese bağlı olarak etkilendiğini gösterilmiştir. Başka bir çalışmada 47, TNF-α, IL-1 ve IL-6 gibi sitokinler, büyüme ve transkripsiyon faktörleri gibi çoklu mekanizmaların kemik rezorpsiyonu ve yoğunluğu üzerinde etkili olduğunu göstermiştir. Buna ek olarak RANKL, kemik rezorbsiyondan sorumludur 48. RANKL osteoblastlar ve osteositler tarafından salgılanır ve osteoklastlar ve osteoklast öncüleri üzerinde eksprese edilen RANKın reseptör aktivatörüne bağlanarak osteoklastların farklılaşmasını ve aktivitesini düzenler. OPG RANKL'ın RANK ile etkileşimini bağlayıp inhibe edebilen çözünebilir bir reseptördür 49. Daha önceki çalışmalar 10,22, MTXin kanda ve kemikte osteoklast yoğunluğunu artırdığını göstermiştir. Tip 1 kollajen, kemik ekstraselüler matriksinin en önemli bileşenlerinden biridir ve kemik kollajenin yaklaşık %95ini ve toplam kemik proteinlerinin yaklaşık %80ini temsil eder 50. Yapılan bir çalışmada (51), MTX tedavisinin tip 1 kollajeni önemli ölçüde azalttığı görülmüştür. Çalışmada MTX uygulamasının, kontrol ve ASI gruplarına kıyasla NF-κB, RANKL, IL-1β, IL-6 ve TNF-α düzeylerini arttırdığı ve kemikteki OPG ve tip-1 kollajeni azalttığı tespit edilmiştir (Şekil 3). Ayrıca ASI takviyesinin, MTX grubunda NF-κB, RANKL, IL-1β, IL-6 ve TNF-α düzeylerini azalttığı ve OPG ve tip-1 kollajen düzeylerini arttırdığı belirlenmiştir (Şekil 3). Histolojik bulgular, bu çalışmanın diğer sonuçlarıyla benzer şekilde tutarlıdır. Daha önceki çalışmalarla 10,11 uyumlu olarak, MTX grubunda trabeküler kalınlıkta azalma, osteoklast sayısı ve intratrabeküler alanda artma görülmektedir (Şekil 4). ASİ+MTX grubunda ise trabeküller kısmi olarak incelmiş ve osteoklast sayısında kısmi artış tespit edilmiştir (Şekil 4). Bununla birlikte, mevcut bulgular, muhtemelen inflamasyonu ve oksidatif stres artışını azaltarak ASİ'nin kemikteki MTX toksisitesine karşı koruyucu etkisini doğrulamaktadır.
Sonuç olarak, ASİ'nin ratlarda MTX uygulamasını takiben oluşabilecek bir kemik hasarında, osteokalsin ve NF-κB, RANKL, IL-1β, IL-6 ve TNF-α düzeylerini azaltarak ve OPG ve tip-1 kollajen proteinlerinin modülasyonunu düzenleyerek MTXin olumsuz etkilerini azaltabileceği tespit edilmiştir.