Araştırma ve Yayın Etiği: Bu çalışma, Fırat Üniversitesi Deneysel Araştırma Merkezinde, Fırat Üniversitesi Hayvan Deneyleri Yerel Etik Kurulu Başkanlığının 20.03.2019 tarihli ve 59 karar nolu izni ile yapılmıştır. Çalışmada, hayvan deneylerinde uygulanan kurallara ve hayvan refahına uyulmuştur.
Çalışmada ağırlıkları 300±30 gram 2-3 aylık 18 adet erkek Wistar-Albino rat kullanılmıştır. Ratlar 12 saat aydınlık 12 saat karanlık ortamda ve 25±3°C ve %60-65 nem düzeyine sahip standart kafeslerde beslenmiştir. Besin olarak standart rat yemi (Korkuteli Yem, Antalya/ Türkiye) ve şebeke suyu ad-libitum olarak verilmiştir.
Ratlar, her grupta 9 adet olacak şekilde kontrol ve selenyum olarak iki gruba ayrılmıştır. Her iki gruba uygulama öncesi ve sonrası yüzme egzersizi yaptırılmıştır. Kontrol grubuna; plasebo olarak serum fizyolojik, selenyum grubuna ise; 0.8 mg/kg dozda Se intraperitoneal olarak 20 gün süreyle uygulanmıştır.
Yüzme Egzersizi: Deneysel uygulamalar başlamadan önce her iki gruptaki ratlar adaptasyon için, su sıcaklığı 32-34°C olan Morris yüzme tankında yüzdürülmüştür 17. Ratlar yüzmeye adapte olduktan bir gün sonra; uygulama öncesi ve sonrasında her iki gruptaki ratlar, ayrı olacak şekilde, tükenme belirtileri oluşana kadar yüzdürülmüş ve yüzme süreleri kayıt altına alınmıştır.
Ratlar, uygulama sonrası yapılan yüzme egzersizinden hemen sonra anestezi (ksilazin 10 mg/kg/ ketamin 60 mg/kg) altında sakrifiye edilerek kan, karaciğer ve kas örnekleri alınmıştır. Alınan kan örneklerden plazma elde edilmiş ve analiz edilinceye kadar 20°Cde saklanmıştır. Plazma, kas ve karaciğer örneklerinden MDA, GSH düzeyi, katalaz ve GSH-Px aktiviteleri belirlenmiştir. Ayrıca kas ve karaciğer doku örneklerinden HO-1 ve Nrf2 protein ekpresyon düzeyleri Western blot tekniğiyle belirlenmiştir.
Doku Örneklerinin Hazırlanması: Alınan kas ve karaciğer dokuları soğuk zinciri korunarak tartılıp cam tüplere aktarıldı. Dokuların üzerine 1/10 oranında Tris Tamponu (pH:7.4) ilave edilerek homojenizatörde homojenize edildi. Hazırlanan bu homojenat +4°C soğutmalı santrifüjde 45 dakika süre ile 3500 rpmde santrifüj edilerek süpernatant elde edildi. Elde edilen süpernatant kısmından MDA, GSH düzeyleri ile GSH-Px ve CAT enzim aktivitesi belirlendi.
Plazma, karaciğer ve kasların MDA düzeyleri, Placer ve ark. 18nın belirttiği spektrofotometrik yöntem, CAT enzim aktivitesi Goth 19'un belirttiği yöntem, indirgenmiş glutatyon düzeyi Sedlak ve Lindsay 20ın belirttiği yöntem, GSH-Px enzim aktivitesi Lawrence ve ark. 21 belirttiği yöntem ile belirlenmiştir. Dokuların protein tayini bikinkoninik asit (BCA) metoduna göre spektrofotometrik olarak belirlenmiştir 22.
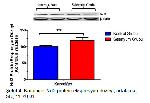
Western blot analizi için her kuyucuğa aynı miktarda protein, poliakrilamid jele yüklenip elektroforetik olarak yürütülmüştür 23 ve SDS-PAGEnin ardından spesifik proteinler Western blotlama tekniği kullanılarak poliviniliden diflorit (PVDF) membrana aktarılmıştır 24. Daha sonra PVDF membranlar, nonspesifik bağlanmaları engellemek amacıyla, bloklama solüsyonu ile muamele edilmiştir. Bloklamanın ardından membranlar Nrf2, HO-1 ve beta aktin primer antikorlarıyla inkübasyona bırakılmıştır. Ardından uygun sekonder antikorlarla muamele edilen membranlarda kemilüminesan konjugat (ECL) kullanılarak elde edilen bantlar kemilüminesans görüntüleme sisteminde (Biorad ChemiDocTM XRS+) görüntülenmiştir. Elde edilen görüntülerdeki bant yoğunlukları uygun analiz sistemi (Biorad Image LabTM Software version 5.2.1. Biorad Laboratories, Inc, ABD) ile ölçülmüştür. Protein ekspresyon düzeyleri internal kontrol olarak kullanılan beta aktine göre normalize edilmiştir 25.
Çalışmada kullanılan kimyasal maddeler analitik saflıkta olup oksidatif stres için Merck (Almanya), Sigma (ABD) firmalarından temin edilmiştir. Western blot analizinde Nrf2 için Thermo, HO-1 için Abcam (İngiltere) firmasından alınan antikorlar kullanılmıştır.
Çalışmada elde edilen sonuçların normal dağılım gösterip göstermediği Shapiro-Wilk normallik analizi ile belirlenmiştir. Shapiro-Wilk normallik analizi sonucu verilerin normal dağılım gösterdiği tespit edilmiştir. Gruplar arasında karşılaştırma yapmak için Bağımsız t testi yapılmıştır. Anlamlılık düzeyi olarak P<0.05 kabul edilmiştir. İstatistiksel analizler için IBM SPSS Statistics 22 paket programı kullanılmıştır. Veriler X±SD olarak verilmiştir.