Matriks metalloproteinazları, östrüs siklusu boyunca ovaryumda meydana gelen yapısal değişiklikleri düzenleyerek reprodüktif fonksiyonları kontrol etmektedir. Çeşitli hormonlar, sitokinler ve büyüme faktörleri tarafından düzenlenen bu yapısal değişiklikler, ovaryum fizyolojisi için oldukça önemlidir
4. Ovülasyon, östrüs siklusu sırasında lüteinleştirici hormon (LH) dalgalanması tarafından harekete geçirilen dinamik bir süreç olarak tanımlanmaktadır. LH, folikül duvarının parçalanması ve oositin ekstrüzyonu ile sonuçlanan bir dizi biyokimyasal olayı başlatmakta ve senkronize etmektedir
19,20. Bu biyokimyasal olaylar yapısal değişiklikleri düzenleyen faktörler ile MMP gibi proteolitik enzimlerin sentezini ve salgılanmasını içermektedir. Ovülasyon öncesi proteolitik olayların etkisiyle meydana gelen ovariyan MMP aktivitesindeki artış ise foliküler ESMde değişikliklere yol açmaktadır. Foliküler ESMdeki bu değişikliklerle bağlantılı olarak foliküler apeksin granuloza hücrelerinde bozulma ve kollajen matrikste parçalanma gözlenmektedir
6.
Matriks metalloproteinaz üyesi olan ADAMTS-1in foliküler yırtılmaya aracılık eden bir proteaz olduğu bilinmektedir. ADAMTS-1, granuloza hücre reseptörlerini bloke eden proteoglikanları parçalayarak bu hücrelerin gonadotropinlere olan hormonal tepkisini kolaylaştırmakta ve oosit salınımına izin vermektedir 21. Ayrıca ADAMTS-1in östrüs siklusu evrelerindeki ovariyan yapısal değişikliklerin düzenlenmesinde etkili olan bazı faktörlerin salınımını veya etkinliğini modüle ettiği düşünülmektedir.
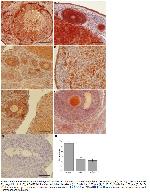
Çalışmada, siklus evrelerindeki dişi sıçanların ovaryum dokularında ADAMTS-1 immünoreaktivitesinin yoğunluğu ve yaygınlığı incelendi. Östrüs siklusu sırasında ADAMTS-1 immünoreaktivitesinin siklus aşamaları boyunca değişiklikler sergilediği tespit edildi. Foliküler gelişimin gözlendiği proöstrüs evresinde boyama yoğunluğunun ve yaygınlığının oldukça dikkat çekici olduğu gözlendi. Bu bağlamda, insan koriyonik gonadotropini (hCG) ile süperovüle edilmiş immatür sıçanlarda olgun foliküllerin granuloza hücrelerine lokalize olan ADAMTS-1in belirgin bir periovülatör artışı ortaya konulmuştur 22. ADAMTS-1 null mutasyonuna sahip farelerde yapılan çalışmalar, ovülasyonun % 70-90 oranında azaldığını kanıtlamıştır. Bununla birlikte bu farelerin, folikülogenezis evrelerinde de belirgin bir gecikme gösterdikleri belirtilmiştir 23. Ayrıca başka bir çalışmada 9, ADAMTS-1 null farelerde oositlerin foliküllerden salınımının azalmasıyla birlikte ovülasyon sürecinin bozulduğu ve infertilitenin oluştuğu bildirilmiştir. Bahsedilen bilgiler doğrultusunda, bu evredeki foliküler gelişimin folikül ESMindeki morfolojik değişiklikleri beraberinde getirdiği ve proteolitik aktivitenin de gerekli olduğu kanısına varılmaktadır. Dolayısıyla ADAMTS-1in de bu yapısal değişiklikler üzerinde önemli bir rolü olduğu düşünülmektedir.
Foliküler gelişimin devam ettiği ve sonrasında ovülasyon sürecinin başladığı östrüs evresinde, proöstrüs evresine göre daha az yoğunlukta ADAMTS-1 immünoreaktivitesi belirlendi. Ovülasyon öncesi aşamada folikül duvarını kaplayan mural hücrelerden salgılanan ADAMTS-1in, genişleyen kumulus hücre matriksine lokalize olduğu ve bu işlem sırasında versikanı parçaladığı bildirilmiştir 9. ADAMTS-1 null farelerde yapılan çalışmalarda, versikan yıkımlanamadığı için ovülator fonksiyonunun bozulduğu ve infertilitenin gözlendiği ortaya konulmuştur. Buna ilaveten bu farelerin ESMnin yeniden şekillenme sürecinin de oluşmadığı saptanmıştır 1. Ayrıca ovülasyon esnasında kumulus oosit kompleksinin ovaryumdan salınabilmesi için tekal hücre ESMnin de parçalanması gerektiği belirtilmiştir 24. ESMde gözlenen bu morfolojik değişikliklerin sonucunda oluşan ürünlerin, ADAMTS-1 işlevselliği için substrat görevi gördüğü ve ADAMTS-1i aktive ettiği ifade edilebilmektedir.
Siberian hamsterlarında östrüs siklusu boyunca ovariyan MMPlerin immünohistokimyasal olarak incelendiği bir çalışmada, diöstrüs evresinde gözlenen MMP yoğunluğundaki azalmanın, östradiol (E2) konsantrasyonundaki düşüş ile bağlantılı olduğu ifade edilmiştir 4. Ovülasyon sonrası regresyon süreci olarak tanımlanan diöstrüs evresinin başlarında, E2 seviyelerinin düşük olduğu bilinmektedir 25. Ayrıca bu evrede antral foliküllerin sayısının ve foliküler hücre boyama yoğunluğunun azaldığı bildirilmiştir 4. Benzer şekilde çalışmada diöstrüs evresinde, ADAMTS-1 immünoreaktivitesinin tüm ovarian hücrelerde azaldığı belirlendi.
Bu gözlemler ışığında, sıçan ovaryumunun farklı östrüs siklusu evrelerindeki immünohistokimyasal ve moleküler ADAMTS-1 ekspresyonuna daha önce rastlanmamıştır. Bu çalışma normal ovarian siklusundaki ADAMTS-1 lokalizasyonunu inceleyen ilk araştırmadır. Elde edilen sonuçlar ile bu süreçteki bir dizi olayın meydana gelebilmesi için ADAMTS-1in anahtar bir rol oynadığı gösterilmektedir. Foliküler gelişim, ovülasyon ve regresyon süreçlerini içeren farklı siklus evrelerinin ESMindeki yapısal değişikliklerle ilişkili olarak ADAMTS-1 immünoreaktivitesinde farklılıklar olduğu belirlendi. Özellikle proöstrüs evresindeki yoğun ADAMTS-1 immünoreaktivitesi, sıçanların preovülatuar döneminde proteazların rolünün oldukça önemli olduğunu göstermektedir. Dolayısıyla ADAMTS-1in reprodüktif fonksiyonlardaki proteaz akvitesinin hala araştırılması gereken yönlerinin olduğu ifade edilebilir.