AKR yaygın endüstriyel kullanımı ve günlük tüketilen gıda ile alımının fazlalığı sebebiyle her geçen gün daha da önemli halk sağlığı sorunu haline gelmiştir. Bu nedenle araştırmacılar son zamanlarda AKR'in toksisite mekanizmalarını aydınlatmak ve hasara karşı yeni terapötik ya da alternatif seçenekler bulmak için yoğun bir şekilde çalışmaktadırlar
1,2,4. Bu çalışmanın amacı AKRin neden olduğu dalak toksisitesi üzerine MORin etkilerini araştırmaktır.
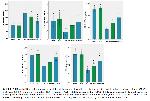
Katı geçirgenliğe sahip, suda çözünür toksik bir madde olan AKR, hızla kan dolaşımına karışabilir ve dalak hasarını tetikleyebilir4-6. AKR kaynaklı hastalıkların patogenezinde süperoksit, peroksitler ve hidroksil radikali gibi oksidatif metabolizmanın yan ürünleri olan ROSnin hücrelerde DNA, ROS ve lipidlere saldırması yatmaktadır1,2,4,19. ROSlerinin vücuttan temizlenmesi için enzimatik (SOD, KAT ve GPx) ve enzimatik olmayan (GSH) antioksidan savunma sistemleri bulunmaktadır 20-22. Vücut homeostasisinin korunmasını sağlayan antioksidan savunma sistemleri AKR maruziyeti sonucu bozulur ve oksidatif stres gelişir 5.
AKRin DNA oksidatif hasarını artırdığı ve antioksidan enzim aktivitesinde azalmaya neden olduğu, böylece doku hasarı gelişimini hızlandırdığı Gür ve ark. tarafından bildirilmiştir4. Yine farklı dokular üzerinde yapılan çalışmalarda MORin oksidatif stresi azalttığı gösterilmiştir1,2,4. Mevcut çalışmada AKRin antioksidan-oksidan dengenin oksidan lehine dönmesine ve oksidatif strese neden olduğu görülmüştür. Bunun olası nedenlerinin AKR'in GSH depolarını tüketmesi ve -SH gruplarına bağlanarak antioksidan enzimleri inhibe etmesinden kaynaklandığı düşünülmektedir. Ayrıca MOR enzimatik ve enzimatik olmayan antioksidan düzeylerini yükselterek lipid peroksidasyonunu azalttığı ve böylece AKR tarafından tetiklenen oksidatif stresi azalttığı belirlenmiştir. Bu sonuçlara bakıldığında MORin antioksidan etkisi, yapısındaki hidroksil grupları tarafından ROS'lerini süpürme özelliğinden kaynaklandığını düşündürmektedir.
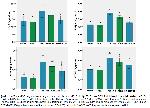
İmmün hastalıkların patogenezinde inflamasyon ana rol oynar. İnflamasyon, vücutta kimyasal, fiziksel veya biyolojik bir maddenin varlığında yanıt olarak ortaya çıkar. Temel transkripsiyon faktörü olan NF-κB immün sistem hastalıklarında, apoptozda ve inflamasyonda kritik düzenleyicisi olduğu iyi bir şekilde belgelenmiştir. NF-κB'nin, IL-1β, TNF-α, ve COX-2, vb. gibi birçok proinflamatuvar aracının transkripsiyonunu destekleyen, inflamatuvar sürecin temel düzenleyicisi olduğu düşünülmektedir23-25. Gür ve ark.4 AKR'nin NF-κB'yi aktive ettiğini ve buna bağlı olarak proinflamatuvar sitokin düzeylerinin artması nedeniyle nöroinflamasyonun meydana geldiğini bildirilmiştir. Kandemir ve ark.1 ise AKR maruziyeti sonrası ROS üretiminin arttığını ve buna bağlı olarak proinflamatuvar yolların tetiklediğini bildirmişlerdir. Sunulan bulgular AKR uygulamasının NF-κB seviyelerindeki artışa ek olarak TNF-α, IL-1β ve IL-6 seviyeleri ile COX-2 aktivitesini arttırdığını ve böylece inflamasyona neden olduğunu ortaya koymuştur. Önceki çalışmalar, MORin çeşitli dokularda NF-κB aktivasyonunu baskılayarak inflamasyonu azalttığını bildirmiştir1,4. Sunulan çalışmada MORin, NF-κB, IL-1β, TNF-α düzeylerini ve COX-2 aktivitesini düşürerek AKR'nin neden olduğu inflamasyona karşı önemli ölçüde koruma sağlayabildiği tespit edilmiştir. NF-κB sinyal yolaklarının inflamasyondaki önemi nedeniyle inflamatuvar ajanlara karşı bu yolakları hedef alan terapötiklerin kullanılması tedavide önemli avantajlar sağlayacaktır.
Apoptozis oksidatif stres ve inflamasyon dahil olmak üzere çeşitli patolojik ve fizyolojik uyaranlar tarafından yönlendirilen programlı hücre ölüm sürecidir. Dokularda belirli sınırda gerçekleşen apoptozis bazı faktörlere bağlı olarak artar ve organlarda disfonksiyona sebep olur. Sistein aspartik asit proteaz aile üyelerinden biri olan kaspaz-3 apoptozun erken evrelerinde aktive olmaktadır25-30. AKR ile ilgili yapılan çalışmalarda farklı dokularda kaspaz-3ün aşırı ekspre olduğu gösterilmiştir1,2. Kandemir ve arkadaşları yaptıkları in-vivo çalışmada AKRin apoptozdan sorumlu kaspaz-3ü arttığını bildirmiştir1. Bu çalışmada sıçanlarda AKR uygulamasının kaspaz-3 aktivitesini artırdığı ve MOR tedavisi ise bir antioksidan olarak kaspaz-3ü azaltabileceği bildirilmiştir. Özetle yüksek doz MORin kaspaz-3 aktivitesini inhibe ettiği ve dolayısıyla MOR'in antiapoptotik etkiye sahip olduğu belirlenmiştir.
Bu çalışmada histopatolojik bulgularımızın biyokimyasal bulgularımızla paralel olduğu görülmüştür. Yapılan in-vivo çalışmalarda AKR maruziyetinin, dalak dokusunun özellikle pulpa sınırlarını ve histomimarisini bozduğu bildirilmiştir5,6,31. Verilerimize göre, AKR uygulamasından sonra dalak dokusunda dejeneratif değişiklikler tespit edilmiştir. Dalak dokusu kırmızı ve beyaz pulpanın normal yapısının bozulduğu gözlenmiştir. Özellikle beyaz pulpanın hücreleri azalmış, hemorajik alanlar, sinüzoidal dilatasyon ve vakuolli hücreler izlenmiştir. Bu patolojik bulguların altındaki sebebin ROS birikimine bağlı olduğu düşünülmüştür. AKR ve MOR verilen gruplarda dalak dokusu incelendiğinde ise normal morfolojide beyaz ve kırmızı pulpa görülmüştür. Ayrıca beyaz ve kırmızı pulpada vakuollü hücreler ve hemoraji azalmıştır.
Akrilamid toksisitesinin artan insidansı ve prevalansı göz önüne alındığında, en etkili ve güvenli tedavi yönteminin veya kombinasyonunun bulunması önemlidir. Bu çalışma, AKRin oksidatif stres, inflamasyon ve apoptozu başlatarak dalak toksisitesine neden olduğunu, MORin AKR kaynaklı dalak hasarını azalttığını, bu etkisini de antioksidan, antiinflamatuvar ve antiapoptotik özellikleri sayesinde sağladığını ortaya koymuştur. Sonuç olarak, elde edilen veriler ışığında MOR in AKR' in neden olduğu dalak hasarına karşı alternatif ya da destekleyici tedavi olarak kullanılması yönünde yapılacak çalışmalara destek sağlaması açısından önemlidir.