IFO, geniş bir katı tümör yelpazesi üzerinde yüksek aktivite sergileyen alkile edici bir ilaçtır
20. IFOin etki mekanizması kesin olarak bilinmemektedir ve esas olarak bir IFO metaboliti olan izofosforamid mustardın neden olduğu guanin, N-7 pozisyonlarında çapraz bağlarla sonuçlanan DNA alkilasyonu yoluyla etki ettiğine inanılmaktadır. DNA'daki bu tersinmez intra ve zincirler arası çapraz bağların gelişimi hücre ölümüyle sonuçlanır
6. IFOin terapötik etkinliğinin yanı sıra, çok çeşitli ve eşzamanlı toksisiteler nedeniyle güvenli kullanımı sınırlıdır. Karşılaşılan yaygın toksisiteler hepatotoksisite, sinir sistemi toksisitesi, kardiyotoksisite, lokal toksisite, kıl folikülü ve cilt toksisitesi, idrar yolu toksisitesi, metabolik anormallikler ve gonadal toksisitedir
6,21. Doğal olarak oluşan antioksidan maddelerin kemoterapötiklerin yan etkilerine karşı koruyucu özellikleri birçok araştırmaya konu olmuş ve araştırmacılar ümit verici sonuçlar elde etmişlerdir
22-25. Bu çalışmada IFO'e maruz kalan sıçanlarda mide hasarına karşı MOR'in etkileri araştırılmıştır.
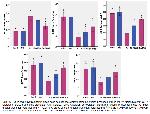
Kemoterapi sonrası oluşan organ toksisitesinin, IFO'in neden olduğu reaktif oksijen türleri (ROT) oluşumuna ve hücre membranlarının lipit peroksidasyonuna bağlı olduğu, oksidatif stresin IFO kaynaklı çoklu organ hasarına katkısı sağladığı yapılan çalışmalarda bildirilmiştir1,9,26,27. ROT ve oksidatif stresin, antikanser ilaçların neden olduğu organ işlev bozukluğunda önemli bir rol oynadığı belgelenmiştir24,28. Ayrıca farklı dokulardaki bozuklukların altında artmış oksidatif stres biyobelirteçleri ile enzimatik ve nonenzimatik antioksidanların tükenmesinin yattığı bildirilmiştir26,29. Oksidanlar tarafından hücresel düzeyde hasar SOD, KAT, GPx gibi antioksidan enzimler ve GSH tarafından zayıflatılır. SOD, KAT ve GPx, süperoksit anyonunun (O2 -) hidrojen perokside (H2O2) dismutasyonunu katalize eder ve bu daha sonra H2O2'yi suya dönüştürür ve böylece reaktif oksijen türlerine karşı koruma sağlar8,26,29. Bu enzimlerin aktivitesindeki azalma, IFO metabolizması sırasında serbest radikal üretimindeki artıştan kaynaklanabilir. Sunulan çalışmada, IFO uygulanan sıçanların mide dokusunda MDA düzeyinde artış gözlenirken, GSH düzeyi ile SOD, KAT ve GPx aktivitelerinde düşüş tespit edilmiştir. Sonuç olarak, IFO sadece mide dokularında serbest radikal oluşumunu arttırmakla kalmamış, aynı zamanda antioksidanların reaktif oksijen türlerini detoksifiye etme yeteneğini de azaltmıştır. Bu nedenle, IFO uygulanan sıçan midesi, antioksidan enzimlerdeki eksiklikler nedeniyle ROT hasarına karşı daha hassastır. Bu çalışmadan elde edilen veriler, IFO ile kombinasyon halinde Morin uygulamasının oksidan düzeyini azaltıp antioksidan enzimleri önemli ölçüde arttırdığını ortaya koymuştur. Öte yandan GSH seviyesindeki artış GPx aktivitesinde artışa yol açmıştır. Ayrıca morinin enzimatik olmayan serbest radikal temizleme ve antilipid peroksidasyon aktivitelerine sahip olduğunu bildiren raporlar da mevcuttur8,11.
Mide hasarının ilerlemesinde bir diğer mekanizma olan inflamasyonun önemli bir rol oynadığı ve oksidatif stresin de inflamatuar süreci tetikleyen bir faktör olduğu bilinmektedir30,31. Oksidatif stres meydana geldiğinde mide hücreleri tarafından inflamatuar sitokinler ve kemokinler salınır32-35. NF-κB inflamatuar yanıtları düzenleyen ana düzenleyici transkripsiyon faktörlerinden biridir ve sitoplazmada IκB ile bir arada bulunur. Protein kinazlar IκB'yi fosforile ettiğinde, NF-κB salınır ve böylece çekirdeğe girerek TNF-α gibi proinflamatuar sitokinleri düzenler 28. Yapılan in vitro bir çalışma, IFO maruziyetinin NF-κB'yi aktive ettiğini ve IκB'nın fosforilasyonu yoluyla proinflamatuar sitokinlerin üretimini arttırdığını göstermiştir12. Mevcut çalışmadaki bulgular IFO'in NF-κB ve TNF-α seviyelerini arttırdığını ve böylece inflamasyona neden olduğunu ortaya koymuştur. Ayrıca IFO grubuna kıyasla 100 veya 200 mg/kg MOR tedavisinin NF- κB ve TNF-α düzeylerini düşürerek IFO' in neden olduğu mide inflamasyonuna karşı önemli ölçüde koruma sağlayabildiği tespit edilmiştir. Yapılan farklı çalışmalarda MORin çeşitli dokularda NF-κB ve TNF-α aktivasyonunu baskılayarak inflamasyonu azalttığı bildirmiştir9,12. Sunulan bulgulardan yola çıkarak morinin, TNF-α kaynaklı hücre içi ROT üretimini azaltarak antiinflamatuar etkiler sergilediği tespit edilmiştir.
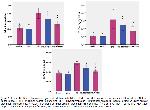
Nötrofillerin inflamasyon bölgesine infiltrasyonu, antijenlerin inaktivasyonunu sağlamada önemli role sahiptir. Ancak bu olayların aşırı olması ve nötrofillerin azurofilik granüllerinden salgılanan ve doku nötrofil içeriğini yansıtan MPO düzeylerinin artması doku hasarının şiddetlenmesine neden olur. MPO, aktif nötrofiller ve makrofajlar tarafından salınan bir kemokindir. MPO'ın güçlü prooksidan ve proinflamatuar özelliklere sahip olduğu bilinmektedir36-38. Turan ve ark.38 kemoterapötikler ile yaptıkları bir çalışmada MPO ın inhibe edilmesinin nötrofil infiltrasyonunu önleyebileceği ve inflamasyona karşı önemli bir etkiye sahip olabileceğini bildirmiştir. Bu çalışmada, IFO verilen sıçanların mide dokusunda nötrofil sayılarındaki artışa bağlı olarak MPO artışının tetiklendiği ve inflamasyonun arttığı, MOR uygulaması ile MPO aktivitesinin azaldığı ve bunun IFOin neden olduğu inflamasyonu hafiflettiği görülmüştür.
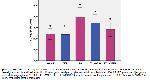
8-OHdG seviyesinin ölçümü genellikle oksidatif strese son derece duyarlı bir makromolekül olan DNA hasarını belirlemek için kullanılır. Oksidatif DNA hasarı, şeker modifikasyonları ve DNA bazları, kovalent çapraz bağlanma, çift ve tek sarmallı kopmalar dahil olmak üzere ROT tarafından saldırılan DNA molekülleri tarafından indüklenir12. Kemoterapötiklerin birincil biyolojik hedefinin DNA olduğu düşünülmektedir. Kemoterapi ilaçları DNA'yı bağlar ve sarmallar arası çapraz bağların ve sarmal içi çapraz bağların oluşumuna yol açar. Bu DNA çapraz bağları, DNA çift sarmalının bozulmasına ve ayrıca DNA transkripsiyonunun ve replikasyonunun bloke edilmesine neden olur12,24. Mevcut çalışmada, IFO ile tedavi edilen gruptaki sıçanların mide dokusunda 8-OHdG düzeylerinde önemli bir artış gözlenirken, MOR ile destekleyici tedavinin 8-OHdG düzeylerini azalttığı tespit edildi. Özetle sıçanlarda IFO ile indüklenen mide hasarında, MOR' in 8-OHdG seviyesini düşürerek oksidatif DNA hasarını azalttığı belirlendi.
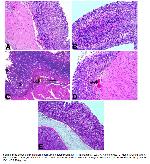
Histopatolojik inceleme sonucunda mide dokusunda IFO' in apoptotik/nekrotik mekanizmasına bağlı olarak inflamatuar hücre infiltrasyonu, mukozal deformasyonlar, kanamalar ve gastrik bezlerde dilatasyonlara sebep olduğu gözlendi. Özdemir ve ark.9 farklı dokuda yaptıkları histolojik çalışmada IFO kaynaklı olarak doku bütünlüğünün bozulduğunu ve dejeneratif değişiklikleri tespit ettiler. Sunulan bulgularda MOR ile tedavi edilen gruplarda, hala bir miktar konjesyon görülmesine rağmen, mukoza ve submozadaki yapıların normal şekil ve boyutta olduğu görüldü. Bununla birlikte, IFOin sebep olduğu mide toksisitesine karşı yüksek doz MORin daha etkili olduğu ve morinin koruyucu etkiyi antioksidan ve antiinflamatuar özellikleri sayesinde gösterdiği muhtemeldir. Ayrıca yapılan araştırmalarda MORin histopatolojik değişiklikleri de iyileştirdiği vurgulanmıştır8,9.
Sonuç olarak, kemoterapide yaygın olarak kullanılan IFO'e maruz kalan sıçanlarda mide hasarı farklı yöntemlerle incelendi. IFO toksisitesi, sıçanların mide dokularında oksidatif strese, inflamasyona, DNA hasarına ve patolojik değişikliklere neden oldu. MOR uygulamasının IFO kaynaklı oksidatif stresi ve inflamasyonu baskılayarak hasarı azalttığı tespit edildi. MORin mide dokusundaki antioksidan ve antiinflamatuar etkileri oksidatif stres ve inflamasyon ile ilişkili çeşitli dejeneratif bozuklukların tedavisinde potansiyel bir terapötik ajan olarak yararlı olabilir.