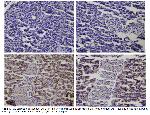
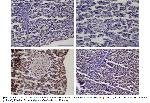
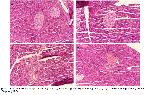
Diyabet, pankreastaki beta hücrelerinde fonksiyon kaybıyla oluşan ve yüksek kan glikozu ile karakterize bir sendromdur
19. Kronik kan glikoz seviyesi yüksekliği, reaktif oksijen türlerinin fazla üretilmesine ve vücutta redoks dengesinin değişimine neden olarak oksidatif stresi tetiklemektedir
20.
Finasteride etken maddesi, benign prostat hiperlazisi, hirsutizm, aknenin tedavisi ve kontrolünde, ayrıca prostat bezinin küçültülmesi sonucunda idrar akımının rahatlama gibi semptomların azaltılması amacıyla kullanılmaktadır. Ek olarak prostat kanseri ve androjenik alopesinin tedavisinde de etkili olduğu bilinmektedir21.
Hücrelerde apoptozisi uyaran birçok tetikleyici ajan bulunmaktadır. Hücrenin uyarıcılara karşı duyarlılığı antiapoptik ve proapoptotik gen ekspresyonu ve uyarıcının şiddetine göre farklılıklar göstermektedir. Oksidatif stresi takiben oluşan intrinksik faktörler apoptozisi tetiklemektedir. Apoptozisin regülasyonunda görev alan Bcl-2 ailesinin Bax gibi proapoptik üyeleri mitokondrinin membranı ile ilişki kurarak hücreyi apoptozise götürürken, antiapoptik Bcl-2 gibi üyeler ise mitokondri membranının dış kısmında bulunur ve hücrede yaşamın devam etmesini sağlar22.
Motawi ve ark.23 STZ ile oluşturulan diyabette kan glikoz seviyesinin yükseldiğini ve böbrek fonksiyonlarının bozulduğunu bildirmişlerdir. Yapılan çalışmada literatürle uyumlu olarak STZ uygulamasından 72 saat sonra hipergliseminin şekillendiği (kan glikoz değerlerinin 250 mg/dL üzerine çıktığı) tespit edilmiştir.
Aughsteen24, tek doz STZ uygulamasından sonra rat pankreas β hücrelerinde kromatin biriktiğini, çekirdekte piknozis ile birlikte endoplazmik retikulum ve mitokondriyal dejenerasyon oluştuğunu bildirmiştir. Bu çalışmada da STZ ile oluşturulan diyabet modelinde ratların pankreas dokularının histopatolojik olarak diyabet grubunun; endokrin komponentinin Langerhans adacık hücrelerinde atrofi, dejenerasyon ve konturlarında düzensizleşme ile piknotik hücrelerinde hasar ve sitoplazmik kısımda vakuolizasyon olduğu tespit edildi.
Kan glikoz düzeyinin yükselmesi dokularda serbest oksijen radikallerinin üretimini artırdığı için oksidatif strese neden olmaktadır25. Literatür taramaları sonucunda STZ ile oluşturulan diyabetik ratlarda ve diyabet hastalarında reaktif oksijen türlerinin üretiminin arttığı belirlenmiştir. Oksidatif stres durumunda lipid peroksidasyon seviyesinde artış ve glutatyon homeostazisinde bozulmalar belirlenmiştir26,27. Yapılan bir araştırmada28 diyabetin serbest radikallerin oluşumunu arttırdığı ve antioksidan mekanizmaların etkinliğini baskılayarak oksidatif strese neden olduğu belirlenmiştir.
Farklı çalışmalarda29,30 araştırıcıların aynı fikirde oldukları konu diyabette antioksidan mekanizmaların inhibe olduğu ve lipid peroksidasyonunun yükseldiğidir. Bu amaçla diyabet tedavisinde antidiyabetiklerle birlikte antioksidanların kullanılmasının organizmada oksidatif stresi azaltmak için gerekli olduğu belirtilmiştir. Hücrenin lipid peroksidasyonuyla son ürün olan MDA seviyesinde artış görülmektedir. Yapılan çalışmada diyabet grubu kontrol grubu ile karşılaştırıldığında total antioksidan seviyedeki artış ile MDA seviyesindeki azalma arasında güçlü bir bağlantı olduğu ve sonuçların Obrosova ve ark.29 ve Kataya ve ark. 30nın yaptığı çalışmaların sonuçlarıyla benzerlik gösterdiği belirlenmiştir.
Halifeoğlu ve ark.10 tip 2 diyabetik hastalardan aldıkları örneklerde serum antioksidan vitaminler, açlık kan şekeri, MDA, eritrositte HbA1c, SOD, GSH-Px ve katalaz enzim aktiveleri ile HDL-LDL kolesterol düzeylerini değerlendirdiklerinde, tedavi sonrası kan glikoz düzeyinde düşme, HBA1c ve MDA düzeyinde azalma, SOD seviyesinde ise artış olduğunu belirtmişlerdir.
SOD aktivitesinin diyabetli bireylerde düşük olduğu, diyabetli gruplara E vitamini uygulaması ile seviyesinin arttığı fakat bu artışın kontrol grubu düzeyine ulaşmadığı bildirilmiştir. Aynı çalışmada SOD aktivitesi baskılanırken GSH-Px seviyesinin arttığı fakat bunun lipid peroksidasyonunu engelleyemediği tespit edilmiştir31. Yapılan bu çalışmada da literatürle uyumlu olarak diyabet grubunda SOD seviyesinde azalma belirlenmiş ve finasteride uygulamasıyla bu seviyenin arttığı tespit edilmiştir.
Usta ve ark.32 deneysel diyabet modelinde karaciğer dokusunda TAS seviyesinin azaldığını, antioksidan etkili timokinon uygulaması ile azalan TAS düzeyinin belirgin bir şekilde arttığını tespit etmişlerdir. Mevcut çalışmada deneysel oluşturulan diyabet modelinde literatürle uyumlu olarak TAS seviyesinin düştüğü, finasteride uygulaması ile ılımlı derecede arttığı belirlenmiştir.
Diyabetin apoptozisi indükleyerek testislerde hücre ölümüne neden olduğu ve apoptozisin yüksek şekerin indüklediği oksidatif stres sonucu meydana gelen testis hasarından kaynaklandığı belirtilmektedir33,34. Yapılan bir araştırmada diyabetli sıçanların testis dokusunda pro-apoptotik protein olan Bax ekspresyonunda düşüş ile antiapoptotik Bcl-2 ekspresyonunda artış tespit edilmiştir35. Farklı bir çalışmada ise diyabetik sıçanların kalp dokusunda Bcl-2 gen expresyonunda azalma, kaspaz-3, 8 ve 9 seviyesinde yükselme ile birlikte apoptotik hücre sayısında artış tespit edilmiştir36. Yapılan araştırmalarla37 uyumlu olarak diyabetik sıçanların pankreas dokularında apoptoziste artış olduğu belirlendi.
Finasteridin antioksidan etkisi, nükleer faktör eritroid 2 (Nrf2) aktivasyonu yoluyla olabilir. Nrf2, inflamatuar mediatörlerin ekspresyonunu ve mitokondriyal fonksiyonları etkileyebilir36. Proinflamatuar faktörler, Nrf2 tarafından bloke edilebilir ve Nrf2, proinflamatuar sitokinlerin ekspresyonunu düzenler38-40. Nrf2 aktivatörü olarak finasteridi incelediğimizde diyabetik sıçanlarda finasterid uygulaması ile MDA düzeylerinde anlamlı bir düşüş olduğu belirlendi. Biyokimyasal bulgular, önceki çalışmalarla uyumlu olarak, bilinen anti-androjen etkisine ek olarak finasteridin antioksidan rollerini açıkça göstermiştir.
Sonuç olarak, elde edilen bulgular, diyabetin pankreasta hasara sebep olduğunu ve bunun oksidatif strese yol açtığını göstermektedir. Diyabetli canlılarda hirsutizm, androjenik alopesi, akne, benign prostat hiperplazisi ve prostat kanserinin tedavisi amacıyla finasteride kullanılırken dikkat edilmesi gerektiği, apoptozise bağlı nöronal hasara engel olabilmek açısından önem arz etmektedir. Diyabette antioksidan maddelerin kullanılmasının hastalığın seyri açısından önemli olduğu düşünülmektedir. Finasteride uygulamasının diyabette oluşan lipit peroksidasyonu ve oksidatif stres ile apoptozis üzerine etkisinin olduğu ve bu bulguların daha fazla moleküler düzeyde çalışma ile desteklenmesi gerektiği kanısına varılmıştır.
Teşekkür
Biyokimyasal analizlerin değerlendirilmesinde yardımcı olan Doç. Dr. Hasan AKŞİT (Balıkesir Üniversitesi Veteriner Fakültesi Biyokimya Ana Bilim Dalı) ve immünohistokimyasal ve histopatolojik analizlerin yorumlanmasında yardımcı olan Doç. Dr. Eren ALTUNa (Sağlık Bilimleri Üniversitesi Bağcılar Eğitim ve Araştırma Hastanesi Patoloji Bölümü) teşekkür ederiz.