Çalışma sonucunda elde edilen rutin biyokimyasal parametreler tablo
II de gösterildi. Aspartat transaminaz (AST) ve Alanin transaminaz (ALT) değerlerinin kontrol gruplarına göre CCL
4 uygulanmış grupta oldukça anlamlı artış gösterdiği saptandı ( b p<0.001 (grup 3-1 ve grup3-2)). CCL
4 ile birlikte soy izoflavon verilen grupta da kontrol gruplarına göre anlamlı bir artış olmakla beraber (a P<0.05 (grup 4-1 ve grup 4-2)), sadece CCL
4 verilmiş grupla karşılaştırıldığında anlamlı bir azalma olduğu gözlendi (b P<0.001 (grup 4-3)). Plazma gama-glutamil transferaz (GGT) düzeylerinde de özellikle CCL
4 uygulanmış grupta; kontrol gruplarına göre anlamlı bir artış olduğu ( c P<0.001 (grup 3-1 ve grup3-2)), CCL
4 ile birlikte soy izoflavon uygulanan grupta ise kontrol gruplarına göre anlamlı olarak yüksek olmakla beraber ( b P<0.01 (grup 4-1 ve grup 4-2)), CCL4 verilen gruba göre anlamlı olarak azaldığı gözlendi (a P<0.05 (grup 4-3)), (Tablo
II).Gruplarda total protein ve albumin düzeylerinin ise özellikle CCL
4 uygulanmış grupta , kontrol gruplarına göre anlamlı olarak azaldığı gözlendi (a P<0.05 (grup 3-1 ve grup3-2)). Alkalen fosfat düzeyleri ise CCL
4 uygulanmış ratlarda kontrol gruplarına ve CCL
4 ile birlikte soyisoflavon uygulanmış gruplara göre anlamlı olarak artış gösterdi (sırasıyla b P<0.001 (grup 3-1), a p<0.05 (grup3-2) ve (grup 3-4)). Kontrol grubu ile sadece soy izoflavon verilen grup arasında rutin parametreler arasında alkalane fosfataz dışında (b P<0.01 (grup1-2)) anlamlı bir farklılık gözlenmedi.
CCL
4 uygulanmış ratlarda plazma MDA düzeylerinin, kontrol grupları ve CCL
4 ile birlikte soy izoflavon verilen grupla karşılaştırıldığında anlamlı olarak yüksek olduğu gözlendi (sırasıyla b P<0.01 (grup 3-1 ve grup3-2) ve a P<0.05 (grup3-4)). (Tablo
III). Karaciğer doku MDA düzeyleri de CCL
4 uygulanan grupta, kontrol gruplarına göre anlamlı olarak yüksekti (b P<0.01, (grup 3-1 ve grup3-2)). CCL
4 ile birlikte soy izoflavon uygulanan grupta karaciğer doku MDA düzeylerinin ise soy izoflavon verilen kontrol grubuna göre anlamlı olarak yüksek iken (a P<0.05, (grup 4-2)), CCL
4 uygulanan grupla kıyaslandığında ise karaciğer doku MDA düzeylerinde anlamlı bir azalma olduğu gözlendi (a P<0.05 (grup 4-3)) (Tablo
III, Şekil
1, Şekil
2).

Büyütmek İçin Tıklayın |
Tablo 3: Çalışma gruplarında elde edilen plazma ve karaciğer doku MDA düzeyleri ile plazma paraoksonaz ve arilesteraz düzeyleri |

Büyütmek İçin Tıklayın |
Sekil 1: Çalışma gruplarında plazma MDA düzeyleri (a P<0.05 Grup 4 vs 1, 3, b P<0.01 Grup 3 vs 1, 2) |

Büyütmek İçin Tıklayın |
Sekil 2: Çalışma gruplarında karaciğer doku MDA düzeyleri (a P<0.05 Grup 4 vs 2, b P<0.01 Grup 3 vs 1,2) |
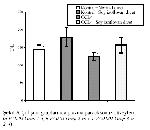
Plazma paraoksonaz aktivite düzeylerinin kontrol grubunda, sadece CCL4 verilen gruba göre anlamlı olarak yüksek olduğu gözlendi (a P<0.05, (grup 1-3). Plazma paraoksonaz düzeyleri, soy izoflavon verilen kontrol grubunda; kontrol grubu ve sadece CCL4 verilen gruba göre anlamlı olarak yüksekti (b P<0.05, (grup 2-1), c P<0.001 (grup 2-3)). Sadece CCL4 uygulanan gruptaki plazma paraoksonaz düzeyleri ise CCL4 ile birlikte soy izoflavon verilen grup ile kıyaslandığında anlamlı olarak düşüktü (c P<0.001 (grup 3-4)) (Tablo III, Şekil 3, Şekil 4).
Büyütmek İçin Tıklayın |
Sekil 3: Çalışma gruplarında plazma paraoksonaz düzeyleri (a P<0.05 Grup 1-3, b P<0.05 Grup 2 vs 1, c P<0.001 Grup 3 vs 2 ,4) |
Büyütmek İçin Tıklayın |
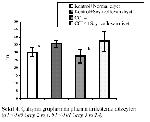
Sekil 4: Çalışma gruplarında plazma arilesteraz düzeyleri (a P<0.05 Grup 2 vs 1, b P<0.01 Grup 3 vs 2,4) |
Plazma arilesteraz düzeylerinin ise sadece CCL4 uygulanan grupta; diğer gruplara göre anlamlı olarak düşük olduğu gözlendi (sırasıyla, a P<0.05 (grup3-1), b P<0.01 (grup 3-2 ve grup3-4)).
CCL4 uygulanmış grupta plazma MDA düzeyleri ve paraoksonaz düzeyleri arasında negatif yönde anlamlı bir korelasyonun olduğu gözlendi. (r:-0.537, p<0.01).
CCL4 ile birlikte soy izoflavon uygulanmış grupta özellikle plazma MDA düzeyleri ve paraoksonaz düzeyleri karşılaştırıldığında da negatif yönde anlamlı bir korelasyonun olduğu gözlendi (r:-487 p<0.01)
Histopatolojik bulgular
Tablo IV de görüldüğü gibi CCL4 uygulanmış grupta yağlanma (steatozis) derecelerine bakıldığında sadece CCL4 verilmiş gruptaki steatozisin, soy izoflavon uygulamasıyla anlamlı olarak gerilediği görülmüştür (a P<0.05, (grup 3-4)). Ayrıca CCL4 uygulanmış grup inflamasyon ve nekroz açısından değerlendirildiğinde artmış olan inflamasyon ve nekrozun, CCL4 ile brlikte soy izoflavon verilen grupta anlamlı olarak azaldığı (a P<0.05 (grup3-4), b P<0.01 (grup3-4)), yine CCL4 uygulanmış gruptaki fibrozisinde soy izoflavon uygulaması ile anlamlı olarak gerilediği gözlendi (b P<0.01 (grup3-4)) (Tablo IV, Şekil 5, Şekil 6).

Büyütmek İçin Tıklayın |
Sekil 5: CCL4 uygulanmış ratlarda karaciğer dokusunda fibrozis ve inflamasyon hidropik dejenerasyon ve yağlanma (Massaon Trichrom X200) |
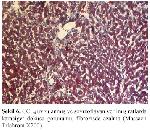
Büyütmek İçin Tıklayın |
Sekil 6: CCL4 uygulanmış ve soyizoflavan verilmiş ratlarda karaciğer dokusu görünümü, fibrozisde azalma (Massaon Trichrom X200). |












