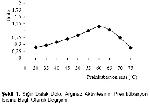
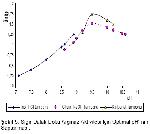
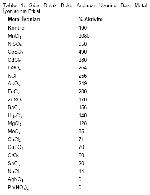Enzimlerin genel yapısı protein kaynaklı olması nedeniyle ısıya dayanıklı değillerdir. Maksimum aktivite gösterdiği ısının üstüne çıktığı zaman enzim aktivitesi düşmektedir. Sığır dalak doku arginazı için preinkübasyon ısısı 62 ºC, zamanı ise 15 dakika olarak bulunmuştur. Colombo ve Konarska
12 55 ºC' de 20 dakikalık bir preinkübasyonun karaciğer arginaz aktivitesini 4-5 kat eritrosit arginaz aktivitesinin ise 2-6 kat arttığını saptamışlardır.
Preinkübasyon ısısı ve zamanı değişik hayvan ve dokularda incelenmiş koyun meme doku arginazı için 52 ºC' de 12 dakika3, koyun gözü vitreusu için 40 ºC' de 9-10 dakika7, insan tükürüğü için 55ºC' de 20 dakika8, tiroid dokusu için 55 ºC' de 12 dakika6, sığır rumen doku arginazı için 60 ºC' de 5 dakika4, rat karaciğeri için 68 ºC' de 12 dakika13 olarak tespit edilmiştir.
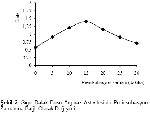
Sığır dalak doku arginaz aktivitesinin inkübasyona bağlı değişimi incelendiğinde 10 dakikaya kadar lineer bir artış görülürken, 10 dakikadan sonra lineerliğin bozulduğu saptanmıştır. Yapılan çalışmalarda farklı dokular için değişik inkübasyon süreleri: insan tiroid arginazı için 30 dakika6, rat karaciğeri için 20 dakika13, koyun gözü vitreusu için 10 dakika7, sığır rumen doku arginazı için 13 dakika4, insan karaciğer ve uterusu için 20 dk14, koyun meme doku arginazı için 15 dakika3 olarak tespit edilmiştir.
Metal iyonları bir dokudaki enzimi aktive ederken diğer dokudaki enzimi inhibe edebilmektedir. Spektor ve ark.15, yetişkin ve fötal insanın karaciğer, eritrosit, böbrek, beyin ve gastrointestinal sistem dokularında Mn+2'> Co+2 > Mg+2 iyonları arginazı aktive ederken Ca+2' un inhibe ettiğini ortaya koymuşlardır. Sığır rumen dokusunda Mn+2, Ni+2, Cd+2, Co+2' nın enzimi aktive ettiği, Hg+2', Sn+2, Zn+2, Ag+2, Cu+2, Pb+2, Fe+3 iyonları varlığında ise hiç aktivite görülmediği bildirilmiştir4. Koyun meme dokusunda en yüksek enzim aktivitesi Mn+2' varlığında elde edilmiş, Cd+2, Ni+2, Ca+2, Mg+2, Ba+2, Cu+2, Fe+3 varlığında enzim aktive olmuş, Sn+2, Pb+2 ve Cr+3 iyonları varlığında enzim hiç aktivite göstermemiştir3. Bu çalışmada da sığır dalak doku arginaz aktivitesi üzerine en etkili metal iyonu Mn+2 olarak tespit edilmiş, daha sonra sırasıyla Ni+2, Co+2, Cd+2, Li+1, K+1, Al+3, Fe+3, Zn+2, Ba+2, Hg+2 ve Mg+2 metal iyonlarının enzim aktivitesini artırdığı saptanmıştır. Mo+6, Ca+2, Cu+2, Cr+3, Sn+2 ve Na+1 metal iyonlarının varlığında enzim aktivitesinde azalma görülürken, Pb+2 ve Ag+2 varlığında ise enzim hiç aktivite göstermemiştir.
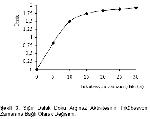
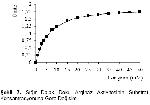
Arginazın tetramerik bir yapıya sahip olduğu ve tetramerik yapının oluşması için Mn+2 katyonlarının gerekli olduğu Muszynska16 tarafından belirtilmiştir. Mn+2 iyonlarının enzime bağlanması ısıya dayanıklılığı artırmakta ve enzimin inaktivasyonlara karşı daha dayanıklı hale gelmesini sağlamaktadır17. Yapılan çalışmalarda farklı dokular için Mn+2 konsantrasyonları farklı olup rat karaciğeri için 2 mM13, M. Benedeni arginazı için 0.5 mM5, koyun meme doku arginazı için 0.75 mM3, insan karaciğeri için 2 mM12 , koyun gözü vitreusu7 ve insan tükürüğü için 5 mM8, sığır rumen doku arginazı için 2 mM4, insan karaciğer ve eritrositi için 2.5 mM14 olarak tespit edilmiştir.
Özçelik ve Özdemir3 preinkübasyon ortamına Mn+2 iyonları ilavesinin enzim aktivitesini artırdığı belirtmektedirler. Bu çalışmada da araştırmacıların3 bulgularına paralel olarak preinkübasyon ortamına Mn+2 iyonları ilavesinin dalak doku arginaz enzim aktivitesini üç kat arttırdığı saptanmıştır.
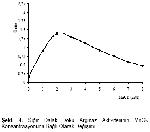
Arginaz enzimi üzerine yapılan çalışmalarda farklı tampon sistemleri kullanılmıştır3,4,6,12,13,18. Bu nedenle araştırmamızda uygun tampon seçimi ve optimal pH araştırılmış, enzim aktivitesi için karbonat tamponunun ve pH 9.7' nin uygun olduğu saptanmıştır. Colombo ve ark12. karaciğer ve eritrosit arginazı için karbonat tampon (pH 9.5) sistemini kullanmışlardır. Koyun meme doku arginazı için en uygun tamponun karbonat tamponu(pH 9.5)3, koyun gözü vitreusu için Glisin-NaOH tamponu (pH 8.8)7, rat karaciğeri için karbonat tamponu (pH 10.1-10.2)13, Moniezia expensa arginazı için karbonat tamponu (pH 9.5)18, sığır rumen doku arginazı için ise karbonat tamponu (pH 10)4 olduğu saptanmıştır.
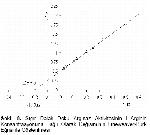
Sığır dalak doku arginazının L- arginine karşı Km değeri Michaelis-Menten ve Lineweaver-Burk eğrileri ile araştırılmış ve 5 mM olarak bulunmuştur. Değişik çalışmalarda Km değerleri: M. Benedeni arginazı için 12.5 mM5, sığır rumen doku arginazı için 4 mM4, insanlar üzerinde yapılan çalışmalarda eritrosit için 3.2 mM, karaciğer için 4.1 mM, uterus için 5.9 mM14, tiroid için 2 mM6 ve vitreus sıvısı arginazı için 6 mM olarak bildirilmiştir7.
Sığır dalak dokusunun bazı kinetik özelikleri ilk kez laboratuvarımızda optimize edilerek değerler tespit edilmiştir. Bu verilerin konu ile ilgili daha sonraki çalışmalara ışık tutacağı kanaatindeyiz.