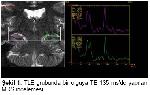
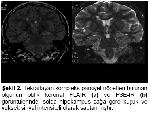
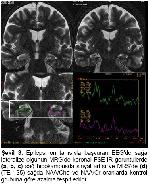
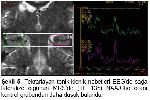
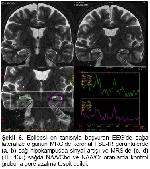
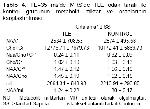Parsiyel başlangıçlı ve tedaviye dirençli nöbetlerin en sık nedeni TLE olup %60-80 kadarını MTS oluşturmaktadır
1,13. İlaç tedavisine yanıt vermeyen MTS olgularında radyoloğun epilepsi odağını doğru olarak göstermesi cerrahi tedavi planlanması açısından oldukça önemlidir
14. MTS’de MRG ile hipokampal atrofi ve patolojik sinyal değişikliği saptanan olgularda cerrahi sonrası %70-90 oranında nöbetlerin gerilediği bildirilmiştir
15. Ancak MRG bulguları normal olan olguların %50’sinde diğer tanı yöntemleri ile belirlenen odağın cerrahi çıkarımı sonrası nöbetlerin kaybolduğuda da bilinmektedir
16. Bu durum konvansiyonel MRG’nin bazı hastalara tanı koymada yetersiz olduğunu göstermektedir. Özellikle iki taraflı tutulumlarda MRG ile odak tarafının kesin olarak belirlenmesi güçtür. Bazı olgularda konvansiyonel MRG bulguları normal olup, MRG’de hacim ölçümleri ve T2 relaksasyon ölçümleri
6 yanı sıra PET ve SPECT gibi inceleme yöntemlerine rağmen odak tarafı ortaya konulamamaktadır
17. Bazen odak tarafının belirlenmesinde intrakranial elektrot yerleştirilerek yapılan EEG incelemesi gibi invazif yöntemlere bile başvurulmaktadır
18.
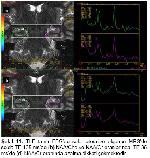
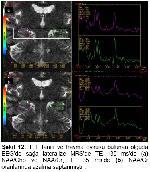
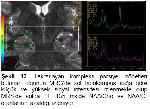
Çalışmamızda TLE’de odak tarafının tespitinde TLE ve kontrol gruplarındaki MRS ve MRG bulguları değerlendirilmiş olup bu bulgular EEG bulguları ile ve birbirleriyle karşılaştırılmıştır.
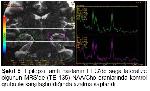
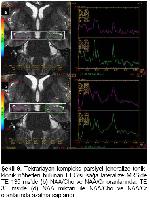
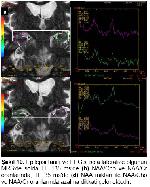
Konvansiyonel MRG bulguları normal olan olgularda ek inceleme yöntemi olarak MRS yaygın olarak kullanılmaktadır. Yapılan pek çok TLE çalışmasında bizim çalışmamıza benzer şekilde, MRS’de odak tarafında NAA pikinde azalma gösterilmiştir4,19,20. NAA miktarındaki azalmada nöron kaybı ve mitokondriyal hasar ile ilişkilidir. Araştırmamızda TE 35 ms’de NAA miktarındaki azalmanın epilepsi odağını doğru göstermede duyarlılığı %55.5 ve özgüllüğü %58 olarak bulunmuştur. EEG’de saptanan odak tarafında daha fazla oranda olmak üzere, karşı tarafta da NAA miktarında azalma olduğu bazı çalışmalarda dikkati çekmektedir21,22. Ayrıca tanısı cerrahi olarak doğrulanan MTS hastalarında hipokampal skleroz derecesi ile NAA metabolitindeki azalmanın orantılı olduğu gösterilmiştir19. İlaç tedavisi ile nöbetleri kontrol altına alınan hastalarda NAA miktarının normale döndüğü de bildirilmektedir23.
Li ve arkadaşları EEG ile MRS bulgularını karşılaştırdıklarında tedaviye dirençli TLE olgularında NAA/Cr oranında azalma tespit etmişlerdir23. Meiners ve arkadaşları patolojik tanı alan TLE hastalarında odak yanı ile karşı tarafı ve kontrol grubunu karşılaştırdık-larında; NAA/Cho ve NAA/Cr oranlarında belirgin azalma göstermişlerdir. Bu sonuç NAA miktarlarındaki azalmaya bağlanmıştır24. Benzer sonuçları gösteren bir başka çalışmada bu metabolit oranlarındaki düşüş, gliozise bağlı Cho ve Cr’deki yükselmeye bağlanmıştır25. Bizim çalışmamızda da TE 135 ms’de NAA/Cho ve NAA/Cr oranları ile TE 35 ms’de NAA/Cr oranı kontrol grubuna göre azalmış ve epilepsi odağını göstermede duyarlı bulunmuştur.
Son zamanlarda yapılan çalışmalarda MTS tanısında en duyarlı MRS bulgusunun NAA/Cho+Cr oranında azalma olduğu bildirilmektedir26,27. Benzer şekilde çalışmamızda da TLE olgularında TE 35 ms’de NAA/Cho+Cr oranı istatiksel olarak anlamlı düşük bulunmuştur. Brandao ve arkadaşları tarafından 0,7128 ve Hakyemez ve arkadaşları tarafından ise 0,6625 değeri bu oran için patolojik sınır olarak kabul edilmiştir. Ancak bizim çalışmamızda hem kontrol hem de hasta grubunda daha düşük oranlar saptanmış olup sırasıyla; 0.32 ve 0.24 olarak ölçülmüştür. Araştırmamızda TE 35 ms’de NAA/Cho+Cr oranının epilepsi odağını göstermede duyarlılığı %69,4, özgüllüğü ise %45 olarak bulunmuştur.
TLE’de Cho+Cr metabolit miktarında yükselme saptanan bazı çalışmalar bulunmakla birlikte29, literatürdeki pek çok çalışma ile benzer şekilde bizim olgularımızda da bu metabolitlerin toplamı hasta grubunda kontrol grubundan farklı bulunmamıştır4,9,11,26. Cr metabolitinin genellikle sabit olup minimal değişiklikler gösterebildiği, bu nedenle de NAA miktarın-daki göreceli değişiklikleri ortaya çıkarmada kullanıldığı da bilinmektedir21,30.
Çalışmamızda TLE olgularında MRS’de lipid-laktat piki bulunduğu dikkati çekmiştir. Ancak TLE’de odak olmayan tarafta da lipid-laktat piki saptanmıştır. Bu nedenle lipid-laktat piki varlığı odak tarafını göstermede yetersizdir bulunmuştur. Bu sonuç literatürde tanımlanan dual patoloji ile uyumlu olup TLE’de bir taraf hipokampus odak bölgesi olmasına rağmen iki tarafta da metabolit değişikliklerinin olabileceğini desteklemektedir. Yapılan bir çalışmada lipid-laktat pikinin akut nöbet döneminde saptandığı, nöbetsiz dönemlerde ise bulunmadığı bildirilmiştir12. Fakat bizim çalışmamızda MRS incelemesi nöbetsiz dönemlerde gerçekleştirildiğinden bu ilişkinin tam olarak değerlendirilemediğini düşünmekteyiz.
Hipokampüs anatomik olarak paranazal sinüslere ve kemiklere yakın olduğundan manyetik alan homojenite-sini sağlamak güçtür. Bu nedenle daha çok uzun TE süreli (135-270) incelemeler tercih edilmektedir. Çünkü uzun TE süreli MRS’de kısa TE sürelerinde görülen su baskılama yetersizlikleri ve yağ kontaminasyonuna neden olan artefaktlar daha az görülmektedir. Bu nedenle de TLE ile ilgili MRS çalışmalarında daha çok uzun TE süreli incelemeler tercih edilmektedir31-33. Ancak uzun TE süresinde elde edilen metabolit sayısı sınırlı olmakta ve mI ölçümü yapılamamaktadır. Biz çalışmamızda her iki TE değerini kullanıp karşılaştırma yaptığımızda, olgularımızda kısa TE süresinde daha fazla sayıda anormallik saptadık. Mueller ve arkadaşları da kısa TE süreli MRS kullanmış olup bu tekniğin uzun TE süreli incelemeler kadar güvenilir olduklarını bildirmişlerdir34.
Birçok merkezde TLE tanısında öncelikle konvansiyonel MRG kullanılmakla birlikte, bazı olgularda MRS değerlendirmesine de başvurulmaktadır. Çalışmamızda TLE’de odak tarafını göstermede MRS’nin duyarlılığı MRG’den daha yüksek bulunmuştur. En duyarlı MRG bulgumuz hipokampal atrofi olup duyarlılığı %27.7, en duyarlı MRS bulgumuz ise NAA/Cr oranında düşme olup duyarlılığı %83.3’tür. Ayrıca MRG’de patolojik bulgu saptanmayan 21 TLE olgusunun MRS metabolit miktar ve oranlarında azalma bulunmuştur.
Sonuç olarak MRS’nin TLE olgularında hipokampal patolojik değişiklikleri MRG’den daha erken dönemde ortaya koyabildiği ve odak tarafınının gösterilmesinde önemli olduğunu düşünülmektedir.