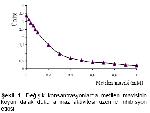
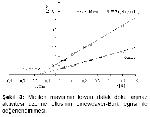
Koyun dalak doku arjinaz aktivitesi üzerine metilen mavisinin fotoinaktivasyon etkisini incelemek için enzim kaynağı 150 watt ışık altında, değişik metilen mavisi konsantrasyonlarına maruz bırakılmıştır. 0.3 mM metilen mavisi varlığında enzim aktivitesinde %72, 0.6mM konsantrasyonda ise % 85’ lik bir azalma tesbit edilmiştir. İnhibisyon tipini belirlemek için 0.3 mM metilen mavisi varlığında enzim aktivitesi incelenmiş ve metilen mavisinin enzimi non-kompetetif inhibisyona uğrattığı saptanmıştır. Çalışmamızla paralel olarak koyun meme doku arjinazı
10, M. Benedeni arjinazı
6, manda karaciğer ve böbrek doku arjinazı
5 ve insan tükürük arjinazının da
11 metilen mavisi tarafından non-kompetetif inhibisyona uğratıldığı belirtilmiştir.
Metilen mavisinin inhibisyon etkisi farklı ortamlarda incelenmiş, oda ışığında aktivitenin % 66’ sının, karanlıkta % 60’ ının ve 150 watt ışık altında ise % 72’ sinin kaybolduğu görülmüştür. Koyun dalak doku arjinaz enzimini, metilen mavisinin 150 wat ışık altında daha güçlü inhibisyona uğrattığı saptanmıştır. Enzimin 150 w ışık altında reaksiyona sokulmasının bir fotoinaktivasyon olayı olduğu kanıtlanmıştır.
Rat karaciğer arjinazı üzerine metilen mavisi ile 150 w ışık uygulanmış ve aktivitedeki düşüşe 21 histidil artığının fotoinaktivasyona uğramasıyla enzimin subünitelere ayrılmasının neden olduğu belirtilmiştir. Fotoinaktivasyon, enzimdeki histidil artıklarının imidazol gruplarının parçalanmasıyla oluşmaktadır. Çeşitli dokularda arjinaz enzimi dimerik yapıdadır. Mn+2 iyonları dimerik yapıya bağlanarak enzimi tetramerik (E- Mn4) yapıya dönüştürmekte ve bu şekilde arjinaz enzimi tam aktivite göstermektedir12. 150 w ışık ve metilen mavisi varlığında enzimin histidil artığının imidazol gruplarının parçalanması ile Mn+2 katyonlarının tetramerik yapıyı oluşturamadığı ve bu nedenle fotoinaktivasyonun meydana geldiği bildirilmiştir5,6,11,13.
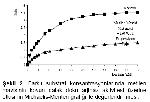
Koyun dalak doku arjinaz enzimine farklı ortamlarda iki preinkübasyon uygulanmış, oda ışığında I. preinkübasyona sadece MnCl2 konularak yapılan çalışma kontrol kabul edilmiş ve diğer çalışmalar bununla kıyaslanmıştır. Bu çalışma sonucunda en az aktivite kaybının Mn+2 ile preinkübasyona sokulduktan sonra metilen mavisi uygulanan grupta (C) olduğu gözlemlenmiştir. Mn+2 katyonları enzimi tetramerik yapıya kavuşturduktan sonra histidil artıklarının yıkımı ve tetramerik yapının değişimi ancak belli miktarda etkilenmektedir. Bu yüzden en az aktivite kaybı bu grupta olmuştur. Ray14, metilen mavisinin oda ışığında fotokimyasal bir oksidant olarak hareket ettiğini ve bu fotokimyasal oksidasyon esnasında proteinlerde bulunan histidin, methionin, sistein, triptofan, tirozin ve sistin amino asitlerinin yan gruplarının değişime maruz kaldığını bildirmiştir. Moss15, arjinaz enziminin substrat ilave edilmeden inhibitörle karşılaştığında inhibisyonun daha fazla olduğunu, substrat ile inhibitör karşılaştıktan sonra enzim ilave edildiğinde ise inhibisyonun daha az olduğunu bildirmiştir. Elde ettiğimiz sonuçlar literatürlerle uyum içerisindedir.
Sonuç olarak metilen mavisinin her türlü ortamda koyun dalak doku arjinazı üzerine inhibisyon etkisinin olduğu, ışığın (150 W) eklenmesi ile inhibisyonun daha da arttığı ve enzimin fotoinaktivasyona uğradığı tespit edilmiştir. Bu fotoinaktivasyona da enzimin histidil artıklarının imidazol gruplarının parçalanması ve enzimin aktivasyon gösterdiği tetramerik yapısını oluşturamamasının neden olduğu düşünülmektedir. Metilen mavisinin ve ışığın bu inhibisyon etkisinin engellenmesinin mümkün olmadığı ancak enzimin önce aktivatörle muamele edilerek tetramerik yapıya kavuştuktan sonra inhibitörle muamele etmenin inhibisyonu azaltacağı sonucuna ulaşılmıştır.