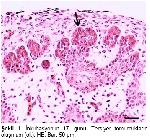
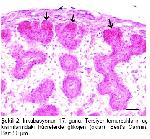
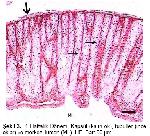
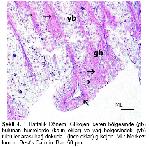
Üropigi bez kuşlarda kuyruğun dorsalinde bulunan tek deri bezidir
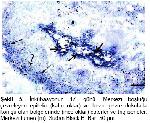
1-3. Organ bağ dokusundan oluşan bir kapsülle sarılmıştır ve iki lobtan oluşmuştur
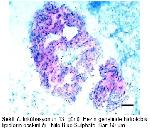
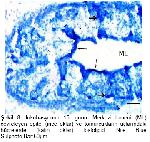
4-7.Her lob, merkezi bir kanal çevresinde radiyer tarzda dizilmiş, çok katlı epitel ile örtülü çok sayıda tubul içerir.
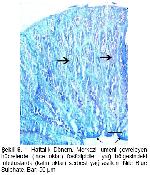
6-10. Histokimyasal tekniklerin uygulanması sonucunda üropigi bezinin iki tabakadan oluştuğu bildirilmiştir. Her tubul bir sebasiyoz bir de glikojen katmanından oluşur. Glikojen tabakası lobun lümenine doğru devam eder
3.
Holokrin salgı yapan üropigi bez yağ ve yağlı maddeleri üretir3.Üropigi bezinin salgısı, yağ asidi esterlerinden oluşan mumlar, uzun ve kısa zincirli yağ asitleri, trigliseridler, yağ sentezinde rol alan enzimler ve hücre yıkıntılarını içeren kompleks bir bileşime sahiptir11. Kuyruk tüylerinin hareketiyle bütün tüy ve teleklerin üzeri salgıyla kaplanarak, tüylerin yağlanması sağlanır6,12.
Bazı araştırıcılar13,14 üropigi bezinin memelilerdeki yağ bezlerine benzer bir fonksiyon gösterip, gonadal hormonların etkisi altında çalıştığını bildirmişlerdir. Ördeklerde15 ve bıldırcınlarda16 yapılan bir çalışmada üropigi bezinde androjen reseptörlerinin bulunduğu belirtilmiştir.
Farklı kuş türlerinde üropigi bezi üzerine yapılan araştırmalarda5,6,9,10,17 bezin tubul epitelinin yaşa, diyete5, cinsiyete18, türlere6 ve çeşitli hormonlara7,8 bağlı olarak değiştiği bildirilmektedir.
Farklı erişkin kuş türleri üzerinde yapılan çalışmalar sonucunda üropigi bezinin histolojik ve histokimyasal özellikleri4-10,17,19 bulunmasına karşın inkübasyon sürecini de kapsayan çalışma sayısının kısıtlı olması konunun önemini artırmaktadır.
Bu çalışma inkübasyonun 13., 15., ve 17. günlerinde ve inkübasyondan sonraki 1 haftalık dönemde bıldırcın (coturnix coturnix japonica) üropigi bezi'in histokimyasal yapısının belirlenmesi amacıyla yapıldı.