C. abortus’ un lokal olarak plasental fonksiyonları
etkileyerek abort ve perinatal ölümlere yola açtığı
bilinmektedir
12. Bununla birlikte,
C. abortus pozitif
buzağılarda perinatal ölüm, ölü doğum ve abort
oranlarının arttığı görülmekle birlikte, sığırlarda bu
konudaki bilgiler azdır
22-23.
C.abortus prevalansının dünyada sığırlarda %5 ila
%20 arasında olduğu bildirilmiştir6,8,9 . Wang (2001)
abort yapmış ineklerde PZR ile C.abortus’u %34,9, PZR
pozitif olan örneklerin daha sonra embriyolu tavuk
yumurtasına yapmış olduğu ekimlerde %33,3, fetusta ise
%8,3’lük bir oranda tespit etmiştir24. Borel ve ark.
(2006) ıntergenic spacer (IGS-S) PZR ile 235 vakanın
12’sinde pozitif (%5,1)’ lik bulmuştur25. Godin ve ark
(2008) yaptıkları çalışmada reprodüktif problemi olan 70
sürüde yapılan çalışmada 525 ineğin iki tanesini
C.abortus yönünden seropozitif olarak bulmuş,
seropozitif olanlar real time PZR ‘a tabi tutulduğunda ise
Chlamydiaceae 12 kontrol ineğin sadece 2 adet
sıvabında bulunmuştur26. Berri (2009) abort problemi
olan ruminant sürülerinden alınan 67 kliniksel örneğin 16
(% 24)’sında (13 vagial sıvab, 3 plasenta) C. abortus’u
multiplex PZR ile pozitif bulmuştur (Berri, 2009)27.
Sığırlarda C.abortus’un neden olduğu abortlar
konusunda Türkiye’de yapılmış olan serolojik çalışmalar
mevcut olmakla birlikte sınırlı düzeydedir. Gökçe ve ark.
(2007) Kars yöresinde C.abortus yönünden abort yapmış
sığırlardan alınan kan serumlarında ELISA ile % 8,33
(16/192) oranında pozitiflik saptamıştır (Gökçe, 2007)28. Aynı araştırmacı sığırlarda C.abortus
seroprevalansının % 4.76 ile 12.67 arasında değiştiğini
bildirmiştir. Bu çalışma Elazığ ve yöresinde abort yapmış sığırlardan alınan doku örneği materyallerinde C.abortus
varlığının PZR yöntemi ile araştırılmasına yönelik tek
çalışmadır. Bu çalışma %6,3’lük oranda C.abortus’un
neden olduğu sığır abort vakası olduğunu göstermiştir.
Bu çalışmada elde ettiğimiz %6,3’lük pozitiflik oran
yapılan diğer çalışmalarla paralel değerde bulunmuştur.
Chlamydia enfeksiyonlarının prevalansındaki artışın;
sığırların bu enfeksiyona karşı antikor taşımaları,
endometritis, fertilite problemleri ve epizootik sığır abort
hastalıklarının artması ile bağlantılı olduğu açıklanmıştır24,29-31. Rutin teşhiste PZR gibi moleküler
yöntemlerin kullanılması ile hastalığın tespit edilme oranı
artmıştır4,18. Chlamydialarda dıştaki zar proteini
(MOMP gene), CTU ve CHOMP 371 primerleri ile
çoğaltılırken, CPI ve PSI primerlerinin gendeki bölgelerin
birisinden seçilmiş olduğu bildirilmiştir. Clone 8 primerleri
MOMP primerlerinden daha yüksek duyarlılığa sahip
olduğu bildirilmiştir. Bu çalışmada kullanılan clone 8
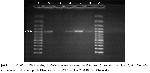
primerleri ile başarılı bir şekilde hedef DNA ‘nın
izolasyonu yapılarak 479 bp’lik ürün elde edilmiştir21.
Bu durum chlamydial genomda helicase geninin birçok
kopyasının olmasıyla açıklanmıştır.
Bu çalışmada toplam 47 kliniksel örneğin 3’ünde PZR
ile C.abortus etkeni için pozitiflik elde edilmiş olup,
bulunan %6,3 lik oran bu yörede C.abortus’un neden
olduğu sığır enzootik abortusunun varlığını göstermekle
birlikte, abort olayları ile mücadelede C.abortus üzerinde
durulması, yine prevalans ve insidens saptanmasına
yönelik olarak çalışmaların yapılmasında fayda
görülmektedir. Ayrıca bu çalışmada PZR ve kültür
sonuçlarının aynı olması, PZR’nin kültüre paralel olarak
kulanılabileceğini göstermektedir.