Anaplasmatocae ailesi, Ricketsiales dizisi içinde yer alan Eperythrozoon soyunda bulunan türler küçük, hareketsiz, prokaryotik ve zorunlu parazitlerdir
1-4. Eperythrozoon, bugün Mycoplasmatocea ailesi içinde bulunan Hemoplasma'lar olarak ifade edilmektedir
5,6. Hastalık dünyanın her yerinde fare, domuz, koyun, keçi ve sığırlarda oldukça yaygındır
3,7-10.
Eperythrozoon ilk kez 1928 yılında Schilling tarafından fare kanında görülmüş ve E.coccoides olarak isimlendirilmiştir11.
Bu soya bağlı türler kanda ikiye bölünerek çoğalırlar. Etkenler affinitelerinden dolayı eritrositlere hücum ederek tutunurlar. Onlardan kolayca ayrılabildiklerinden plasmada da sıkça serbest olarak görülürler. Kan frotilerinde wright ve giemza boyası ile soluk kırmızı, pembe veya mavi, herhangi bir Romanowsky boyası ile kırmızı, akridin turuncusu ile de açık sarıya boyanırlar. Yuvarlak, yüzük, dikdörtgen, çomak veya çok şekilli yığınlar halinde görülürler. Genel olarak 0.4-3.0 μ büyüklüktedirler. Çubuk şekli oldukça kısa ve dallanmamış olup çok nadirdir2,3,12-14. Arthropod vektörlerde etkenin morfolojisi hakkında bir bilgi yoktur1. Teşhiste; indirekt floresan antikor testi (IFAT), komplement fikzasyon testi (KF), indirekt hemaglutinasyon testi (IHA) ve ELISA gibi serolojik testler kullanılır15-19. Ayrıca, polimeraz zincir reaksiyonundan da yararlanılır20. Ayırıcı tanıda; sığır, koyun ve keçilerde anaplasmosis, babesiosis ve theileriosis göz önüne alınmalıdır13. Anemi ve icterus gelişmiş, dalağı büyümüş ve splenektomi yapılmış hayvanlarda enfeksiyon göz önünde tutulmalıdır7,14,21,22.
Tam olarak bilinmemekle beraber bazı türlerin tabii naklinden Arthropoda özellikle kan emen bitler sorumludur. Enfeksiyon kan inokulasyonu ile nakledilebilir2,3,13. Enfeksiyon genellikle latent seyreder. Hayvanda; zayıf bir parasitemi, hafif anemi, hafif ateş ve icterus bulunabilir. Splenektomi çok yüksek parasitemi üretir. Paraziteminin süresi çok değişiktir4,12,13. Fagositosis, intravasküler ve extravasculer hemolisis sonucu oluşan eritrocyst yıkımı anemiye sebep olur. Anemik hayvanlar çok defa ikteriktir. Hastalık genellikle arakonakçıların ölümüne sebep olmaz1,23,24. Kemik iliği, karaciğer, dalak ve safra kesesinde patolojik değişiklikler görülür25,26.
Etkenin dayanıklılığı aşırı derecede değişiklik gösterir13. Çok zayıf olduklarından antiseptiklerle yıkamak onları birkaç dakikada öldürür. Etkenler % 10'luk glycerol veya dimethl sulfoxid (DMSO) karışımında 70ºC'de muhafaza edilebildikleri gibi buzdolabında bekletilen kanda birkaç gün, daha düşük ısılarda bekletilen kanda daha uzun süre ve sıvı nitrojende üç aydan daha uzun süre muhafaza edilebilirler. Eperythrozoon türlerinin kültüre edilemediği bildirilmiştir2.
İsimlendirilmiş 13 türden önemli olanları aşağıda verilmiştir1,27.
- E.coccoides, beyaz fare, Schilling, 1928
- E.ovis, evcil koyun, keçi, Neitz. Alexander and Du Toit, 1934
- E.wenyoni, evcil sığır, Adler and Ellenbogen, 1934
- E.teganodes, evcil sığır, Hoyte, 1962
- E.suis, E.parvum, evcil domuz, Splitter, 1950
Son çalışmalarla Mycoplasma soyu içerisinde incelenen Eperythrozoon türleri Mycoplasma coccoides, M.wenyoni, M.ovis ve M.haemosuis olarak isimlendirilmiştir. Etkenlerin 16S rRNA geni sekanslanarak diğer hemotropik bakteriyel parazitlerle aralarındaki ilişki belirlenmiştir. Filogenetik çalışmalarla bu türlerin Ricketsia olmayıp Mycoplasma soyu içerisindeki Hemoplasma'lar oldukları anlaşılmıştır5,6,28.
E.coccoides: Dünyanın her yerinde laboratuvar farelerinde yaygın olarak bulunur. Hastalık büyük bir problem oluşturur1,4,21,26. Albino ve yabani fareler, albino ratlar, tavşanlar ve hamsterler doğal konakçılardır29.
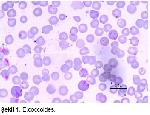
Kan frotilerinde cocci veya oval şekildeki etkenler eritrositlerin yüzeyinde ve plasmada yığınlar halinde görülür30 (Şekil 1). Enfekte eritrositler enfekte olmayanlara göre daha koyu boyanır. Nadiren görülen yüzük formlarının çökmüş cocciler olup frotinin kurutulması esnasında şekillendikleri görülür. Karanlık saha ve fast konstrast mikroskop bakısında cocciler görüldüğü halde yüzük formlar görülmez. Elektron mikroskopta plemorf şekildeki etkenin hücre duvarı ile değil tek katlı bir membranla sarılı olduğu görülür. Cocciler 0.5-1.0 μ olup doku kesitlerinde çok zor görülürler25,31,32.
Splenektomi yapılmamış veya başka türlü immunolojik zarara uğramamış farelerde kolayca görülmeyen etkenler splenektomi veya immun sistem baskısından sonra kolayca görülürler1,25. E.coccoides 1-5 gün nadiren 14 gün sonra gözükür. Bu süre 42 güne kadar da uzayabilir1,3. Splenektomiden sonraki ilk günde çok az eritrosit parazitle enfektedir. En yüksek oranda parazitemi 3.-4. günlerde görülür. Daha sonraki günlerde etkenler azalarak 10.-12. günde kandan kaybolurlar30. Parazitemi süresince bütün eritrocystlerin yüzeyi parazitlerle kaplanmış olabildiği gibi plasmada parazitlerle dolu olabilir. Yoğun parazitemiye rağmen anemi hafiftir veya mevcut değildir. Hafif bir polykromatophilia ve hafif bir ateş oluşur1,3,25. Splenektomi yapılan farelerde (% 26-42) splenektomi yapılmayanlara (% 40-45) göre hematokrit değerde belirgin bir düşüş vardır. Splenektomi yapılan farelerde hemotokrit değer 10. günde en düşük (ortalama % 26) seviyeye düşer3. Sağlam farelerde % 48-55 arasında değişen hematokrit değer enfeksiyondan sonraki 10. günde % 20-25 seviyesine iner33,34. Ağırlık kaybı görülür. Enfekte fareler ortalama 2620-29 gr kadardır.1,3,30. Dalak büyür (2.2-3.0 cm) ve üzerinde koyu kırmızı-siyah renkte bir tabaka oluşur. Dalakta diffuz hemoraji, lenfoid hiperplasi, hemosiderosis ve bazı odaklarda necroz vardır. Karaciğer büyür, kapsülasında kalınlaşma ile karakterize şiddetli tahribat görülür. Genişleyen sinuzoitlerde fazla miktarda eritrosit bulunur. Ayrıca, hemosiderosis, megalositosis, hepatocystlerde dejenerasyon ve nekroz, fokal odaklar halinde eosinofil leukocyst, lenfosit fibroblast infiltrasyonu, kupper hücre aktivasyonu görülür25,30,31. Eritrositin etkenle temas noktasında hafif bir erozyon şekillenir.1,25.
Genç hayvanlarda ve splenektomi yapılmış yetişkinlerde etkenler maximum seviyededir2. Enfeksiyonun immunolojik durumu preimmunisyon şeklindedir. E.coccoides ile enfekte fare serumu Anaplasma marginale ve Haemobartonella muris antijenleri ile reaksiyon verir22.
E.coccoides yalnız başına şiddetli hastalık oluşturmaz. Diğer taraftan tek başına şiddetli hastalık oluşturamayan fare hepatiti virusu (MHV) ile birlikte şiddetli enfeksiyon meydana getirirler.3,21,35. Virusun E.coccoides ile birlikte bulunduğu farelerde titresi sadece virus bulunan farelerdekinden daha yüksektir36. Diğer taraftan, etkenlerin birlikte hafif bir hastalık oluşturmalarına rağmen yalnız başlarına daha şiddetli hastalık oluşturdukları da bildirilmiştir37. Hafif bir hastalık oluşturan Plasmodium chabaudi ile E.coccoides birlikte yine hafif bir hastalık oluştururlar. E.coccoides'in ilaçla elimine edilmesinden sonra P.chabaudi'nin fareleri öldürdüğü görülür. Yine, Plasmodium berghei ile E.coccoides birlikte hafif bir hastalık oluştururlar38. E.coccoides interferon üretimini azaltır33,39.
E.coccoides'in rat bitleri (Polyplax spinulosa, P.serrata) ile mekanik ve biyolojik olarak2,3,29, rat piresi (Xenopsylla cheopis) ile mekanik olarak taşınıp, Myobia musculi, Myocoptes musculinus ve Radfortia ensifera ile taşınmadığı ve oral ve parenteral yolla nakledilebildiği bildirilmektedir1,3,4,21,40. Splenektomi sonrasında enfekte farelerde Polyplax spinulosa ve P.serrata tesbit edildi30. Aneminin devamı süresince parazitler eritrositlerde bulunduklarından dolayı fareler belirsiz taşıyıcılar olarak kalırlar1.
E.cocoides'e; oxytetracycline, chlortettacycline, neosalvarsan, aureomycine ve tetracycline etkili, sülfonlar, penisilin, streptomisin, sülfonamid ve kloramfenikol etkisizdir2,35. Oral yolla üç gün 500 mg/4 lt dozda tetracycline verilen splenektomi yapılmış farelerde uygulamadan sonraki 7.-10. günlerde etken bulunmadı (30). Dört gün süreyle günlük 1.25 mg dozda intraperitonal yolla verilen oxytetracycline oldukça etkilidir13,41.
Koruma amacı ile bit mücadelesi yapılır12,13. Farelerin kullanıldığı deneysel araştırmalarda hastalık dikkate alınmalıdır. Hastalık görüldüğünde komplikasyonlar da görülür.3,21,30,35.
E.ovis: Afrika, Avustralya, Amerika ve Avrupa'da koyunlarda sporadik olduğu ve keçilerinde hassas olabileceği bildirilmiştir3,9,11,24,42. Suudi Arabistan'da 331 koyunda % 3.0, 348 keçide % 3.0 oranında tesbit edildi43.
Giemsa ile solgun mor renge boyanan etkenler eritrositler üzerinde veya plasmada pleomorf, oval, çomak veya halka şeklinde görülürler. Cocci formu var, yüzük formu yoktur. Coccileri 0.5 -1.0 μ büyüklüktedir2,32,44,45. Fast konsrast mikroskop bakısında küre şeklinde görülür. Elektron mikroskopik bakıda 0.3-0.4 μ büyüklüğünde, yuvarlak ve oval şekilde görülen etkenler kısmen eritrocyst içine gömülmüş durumdadırlar. Tabii enfeksiyonlar genellikle subklinik seyreder. Latent enfeksiyonlar tesbit edilmiştir. Parasitemi 1-2 haftalık inkubasyon süresi sonunda gelişir. Ağırlık kaybı, kötü kondisyon, halsizlik, sürünün gerisinde kalma, mukoz membranlarda solgunluk, hızlı solunum, enfeksiyonun şiddetine göre ikterus ve intermitent ateşle birlikte anemi en önemli semptomlardır23,46. E. ovis'in eritrosit membranında deformasyona sebep olduğu, oluşan aneminin eritrofagositosis ve ekstravasküler hemolizden kaynaklandığı düşünülmektedir13,44,47. Nekropside; anemi, sarılık, kan viskozitesinde azalma, perikard ve toraksta sıvı birikmesi, karaciğerde belirgin renk değişimi, safra miktarında artış, dalakta büyüme ve kemik iliğinde hiperplazi görülür46.
Tabii enfeksiyonlar iyi tabiatlı olup ölüm genellikle nadirdir. Preimmunizasyon bir aylık süre içinde gelişir2,9,11,24. Koyun ve keçilerde enfeksiyon şiddetli de seyredebilir48. İnkubasyon süresi 4-21 gündür. Hastalık daha çok süt emen ve sütten yeme yeni geçmiş kuzularda şiddetli seyretmektedir46. Koyunlarda mevsimsel bir seyir gösteren hastalık her mevsimde diğer enfeksiyonlarla birlikte olduğunda nüks edebilir. Ağır ektoparazit enfestasyonu olduğu dönemlerde insidens en yüksektir26. Hastalığa özellikle Merinos koyunları duyarlı olup salgınlar özellikle kış sonu ile ilkbahar başında görülür49. E.ovis, E.wenyoni ve belki de Anaplasma marginale ile ortak antijenlere sahiptir11.
Hastalık; at sinekleri2,11,42, Linognathus ovillus, Hyalomma marginatum ve Rhipicephalus bursa tarafından bulaştırılır13.
Koyun ve keçilerde tetrasiklin, oksitetrasiklin, 6.6 mg/kg dozda, intramüsküler yolla tek uygulamada, neoarsphenamin 30 mg/kg dozda ve antimosan 6 mg/kg dozda kullanılır. Bu uygulamaların sterilizasyonu tam sağlayamadıkları15, imidocarb dipropionate 4 mg/kg dozda subcutan yolla, 24 saat ara ile iki kez uygulandığında sterilizasyonu sağladığı bildirilmektedir50.
E.wenyoni: Dünyada oldukça yaygındır3,11,26,51. Suudi Arabistan'da 43 sığırda % 18.643 ve Arjantin'de splenektomi yapılmış 232 buzağıda % 20.2 oranında bulundu52. Kuzey Nijerya'da enfeksiyona az rastlanır53. Küba'da sığırlarda görülen en önemli kan parazitlerinden biridir54. Küba'da 100 adet düvenin 10'unda tesbit edildi55. Alabama ve Gürcistan'da PCR yöntemiyle 191 sığır kan örneğinin 8'inde pozitif bulundu. Pozitif örneklerden 5'inin kan frotilerinde etken görüldü20. İrlanda'da klinik semptom gösteren 15 sığırın 8'inde tesbit edildi56. Türkiye'de varlığı bildirilmiştir57.
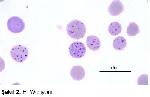
E.wenyoni E.coccoides'e morfolojik olarak benzer. Giemza ile pembemsi mor renge boyanır. Etkenler cocci veya halka şeklinde olup 0.3-0.5 μ büyüklüktedir. Eritrositlerin yüzeyinde 1-50 arasında değişen sayıda, daha çok eritrositlerin kenarında yığınlar halinde ve plazmada da serbest olarak görülürler. Kısa çubuk ve pleomorf formu nadirdir4,11,13,57,58 (Şekil 2). Akridin turuncusu ile boyalı frotilerin floresan mikroskop bakısında etkenler parlak turuncu floresan verir. Bu renk RNA içerdiğini göstermektedir. Belirgin bir nukleus görülmeyebilir. Polychrome metotlarla ve Leischman boyası ile de boyanırlar29,58. Elektron mikroskopta; dikdörtgen, yuvarlak veya küresel şekilde görülen organizma tek bir membranla çevrili olup hücre duvarı bulunmamaktadır11,29,51,59.
E.wenyoni enfeksiyonu genellikle subklinik seyreder. Predispoze faktörlerin varlığında klinik tablo gelişmektedir. Farklı ülkelerde sığırlarda tabii enfeksiyonlar az olarak bildirildiği halde splenektomi sonrası oluşan enfeksiyonlar sıkça bildirilmiştir. Tabii enfeksiyonlarda sığırlarda; zayıf parazitemi, memede, distal bölgede ve arka bacaklarda ödem, ara sıra 40.0-41.0ºC'de yüksek ateş, iştahsızlık, zayıflama, halsizlik, sarılık, lymphadenopathy, kıllarda kabarma, süt veriminde düşüş, kilo kaybı ve nadiren anemi görülür2,11,55-58. Splenektomi yapıldıktan 14 gün sonra kanda yoğun parazitemi, hafif ateş, halsizlik, hafif ve orta derecede anemi, anizocytosis, polychromasia ve bazofili görülür. Enfeksiyon süresi boyunca sedimentasyon oranı artar12,51,56,60. Enfekte boğalarda; hafif mikrositik, normokromik anemi, ateş, sert akciğer sesleri, hızlı solunum, arka bacaklar ve scrotumda ödem, scrotum duvarında kalınlaşma, testislerde dayanıksızlık ve dejenerasyon görülür. Scrotumdaki ödem termoregulasyona engel olduğundan anormal spermatozoit üretimi ile spermatozoit kalitesi ve fertilitede düşüşe sebep olur. Bu anormal değerlerin bazıları boğaların yaşına atfedilebilir51,61. Buzağılarda etkenin kanda bulunduğu sürede aralıklı maximum rektal ısının 40.8 ºC, maximum eritrocyst sayısının 1.61x106 cu / mm, maximum eritrocyst hacminin 84, minimum paket hücre hacminin % 9.3 olduğu ve önemli bir lökositozun bulunduğu görülür62. E.wenyoni, tam olarak bilinmemekle beraber bitler, sokucu sinekler ve Hyalomma anatolicum tarafından bulaştırılır2,3,13. İntravenöz yolla enfekte kan verilen ineklere ve splenektomi yapılmış bir buzağıya etken nakledilebilmiş olmasına rağmen hayvanlarda herhangi bir klınik semptom oluşturulamamıştır55. Etken görülmeyen sığır kanının bir buzağıya inokulasyonundan 17 gün sonra buzağıda tesbit edilen E.wenyoni 15 gün boyunca kanda bulundu.62. İntravenöz yolla enfekte kan verilen dalağı çıkarılmış bir buzağıda 21 gün sonra etken görüldü ve sonraki dört gün kanda bulundu51.
Bazen yüksek parazitemiye rağmen de olsa E.wenyoni çok pathogen değildir. Babesiosis, theileriosis, anaplasmosis ve triponasomiasis etkenleri ile birlikte bulunduğunda tehlikelidir. E.wenyoni, Anaplasma marginale ve A.ovis ile ortak antijenleri paylaşır11,13.
İntramusküler yolla üç gün, günlük 10 mg/kg dozda oxytetracycline uygulaması etkilidir57. İntramusküler yolla 20 mg/kg dozda oxytetracycline ve 1 mg/kg dozda flunixin meglumine uygulaması sonrasında yeme içme düzelir, hayvan daha hareketlenir ve rektal ısı 39.5 ºC'ye düşer. Scrotum ve arka bacaklarda ödem kaybolmaz. Üç gün boyunca kanda görülen etkenler 3. günden sonra kaybolur51. İntramusküler yolla 29 mg/kg dozda oxytetracycline verilen splenektomi yapılmış buzağılarda etkenlerin 24 saat içinde kayboldukları görülür60. Enfekte boğalarda oxytetracycline uygulamasından sonra parazitemi hızla düşer, klinik bulgular yavaş yavaş hafifler, çoğu boğa normal üreme fonksiyonlarını yeniden kazanır61. İntramusküler yolla 5 mg/kg dozda oxytetracycline uygulan sığırlarda semptomlar 24-36 saat içinde azalır58.
E.teganodes: Sığırlarda bulunan diğer tür E.teganodes'tir. Arjantin'de splenektomi yapılan buzağılarda bulundu63.
E.wenyoni ve E.teganodes arasındaki tür ayrımı morfolojik özelliklere göre yapılır. E.wenyoni eritrocystler üzerinde ve plasmada serbest olarak cocci formunda bulunduğu halde4,11,13,57,58,64 E.teganodes plasmada 0.3-3.5 uzunlukta ve 0.2-0,3 µ genişlikte ince çubuklar ve diziler şeklindedir. Nadir olarak çubuklar birkaç kısa çubuğa ayrılmış gibi segmentlidir. Çubuk ve dizi formlarından daha çok görülen halka formları 0.4-1.2 µ büyüklüktedir. Bazı halkaların saplı tavaya benzedikleri görülür. Fast kontrast ve karanlık saha bakısında halka ve tava formlarının kese şeklinde görünmelerine rağmen çubuk ve diziler pek görünmez. Enfeksiyon kan nakli ile oluşturulur64.
E.teganodes enfeksiyonunda neoarsphenamine etkilidir65.
E.suis, E.parvum: Avrasya, Afrika ve Amerika'da domuzlarda görülürler2,13. Çok yaygın olmalarına rağmen önemli kayıplara yol açmazlar66,67.
Disk, cocci ve halka şeklinde olan E.suis 0.8-2.5 µ, E.parvum ise 0.5-0.8 µ'dur. Eritrocystlerin yüzeyinde ve plasmada bulunurlar2,13,27,66-68.
Klinik semptomlarla splenektomiden önce ve sonra kanda görülmeleri ile teşhis edilirler8,19,69-71.
Kötü şartlarda bulunan domuzlarda E.suis ekonomik önemi olan bir enfeksiyon oluşturur2,13. E.suis domuzların ikteroanemisinin nedeni olarak gösterilir13. Hastalık genellikle latent seyreder. Latent enfeksiyonlarda her eritrositde 3-4 adet bulunur. Akut enfeksiyonlarda etkenin kanda görülmesinden hemen sonra vücut ısısı 41-42ºC'ye çıkar. Enfeksiyonun şiddetine göre anemi, ikterus, ürtiker, erithrem ve deride kanamalar görülür. Hastalıkta inkubasyon süresi 9 gündür. Karaciğer kahverengi, safra yapışkan ve sarımsı yeşil renklidir. Dalak büyümüş olup üzerinde lekeler mevcuttur. Kemik iliğinde hiperplasi vardır2,12,27,66,67,69. Süt emen yavrularda hastalanma ve ölüm oranı çok yüksektir. Akut enfeksiyonda yavrular beş gün içinde ölebilirler. Yaşlılarda ölüm gecikebilir ve hayvan iyileşebilir66,67. Morbidite oranı % 5'in altındadır. Mortalite oranı % 80-100 arasındadır12. Hastalık mevsimsel bir seyir gösterir. Yoğun ektoparazit enfestasyonu olduğu dönemlerde insidens yükselir. Yılın diğer zamanlarında diğer enfeksiyonlarla birlikte olunan durumlarda hastalık nüks edebilir26.
Domuz bitleri (Hemotopinus suis) enfeksiyonu nakleder. Etkenlerin parenteral2,13 ve intrauterin taşınması29,72 mümkündür.
Tetracycline ve oxytetracycline'in 50-100 mg/kg dozda ağız yoluyla ve 4mg/kg dozda intramüküler yolla günlük olarak verilmesi oldukça etkilidir3,8,70.
E.parvum'un dalağı çıkarılmış domuzlarda eteş, anemi ve ikterusa sebep olmasına rağmen genelde patojen olmadığı bildirilmektedir2,12,13,27,66,67,69.
E.parvum'a arsenik ve tetracycline etkili olup penicilline, streptomycine ve sulfanomidler etkisizdir2.
Sonuç: Dünyanın birçok ülkesinde hayvanlarda eperythrozoonoosis yaygın olarak görülmektedir. Hastalık verim kayıpları yönünden oldukça önemlidir. Türkiye'de sadece fare ve sığırlarda hastalığın varlığı bildirilmiş olup, az sayıda yapılmış araştırma hastalığın durumu hakkında tam bir fikir vermemektedir. Bu nedenle, farklı yörelerde ve farklı hayvanlarda kapsamlı araştırmaların yapılmasına ihtiyaç olduğu görülmektedir.