Klinik mikoplazmozisin patognomonik semptomu olmadığından ve genellikle de semptomlar klinik olarak önemli diğer enfeksiyonlara benzerlik gösterdiğinden dolayı keçilerin akut mikoplazmal enfeksiyonları hekimler tarafından yanlış yorumlanabilmektedir
13.
Mikoplazmalar genel olarak diğer bakterilerle veya tek başlarına kuzu ve oğlaklarda pnömonilere neden olabilmektedir. Oğlaklar mikoplazmal pnömonilere karşı kuzulardan daha duyarlıdırlar5,7.
M. arginini'nin küçük ruminantlarda solunum sistemi hastalıklarının şiddetini etkileyebilen türler olduğu bazı yayınlarda öne sürülmüş olsa da, deneysel ve epidemiyolojik çalışmalarda henüz patojenitesi tam belirlenememiştir14-16. M. arginini'ye immun yanıt çabuk oluşur ve mikoplazmaları solunum yollarından temizler17. Mevcut çalışmada etkene akciğerlerde rastlanılması muhtemel erken yaştaki bu oğlaklarda henüz immun yanıtın tam gelişmemiş olmasıyla açıklanabilir.
Pnömoni nedeniyle ölen keçilerin akciğer dokularında M. arginini izole edilmesine rağmen18, etkenin hastalıktaki önemi belirlenememiştir. Bu organizmanın genel olarak solunum yolları için primer bir patojen olmadığı düşünülmektedir19-21. Genel olarak M. arginini, enfeksiyonu izleyerek oluşan yangısal yanıtın sonucu olarak elimine edilmektedir22. Her ne kadar bu etken erken dönemde elimine edilse de, bu enfeksiyonun akciğerlerde ilk lezyon oluşumunu uyardığı ve Pasteurella gibi etkenlerin akciğerlere yerleşmesine imkan sağladığı düşünülmektedir23. Bununla beraber M. arginini ile deneysel olarak intratrakeal19, deri altı20 veya kas içi21 yollarla yapılan inokulasyonlarda solunum hastalığı geliştirilememiş ve bu nedenle de keçiler için patojen olmadığı düşünülmüştür.
Yapılan bir deneysel çalışmada, M. arginini ve Pasteurella haemolytica ile beraber oluşturulan enfeksiyonda tipik pnömonik pastörellozistekine benzer şiddetli ve yoğun lezyonlara rastlanılmıştır. Bu çalışmada enfeksiyonun süresi uzadıkça lezyonların genişliğinin de artmış olduğu belirlenmiştir22. Yine bu çalışmada M. arginini'nin keçilerin akciğerinde sadece hafif lezyonlara neden olduğu ve önemli lezyon oluşturmadıkları saptanmıştır.
Bir yayında24 M. ovipneumoniae, M. arginini, Mannheimia haemolytica ve Pasteurella multocida ile enfekte keçilerin oğlaklarında şiddetli solunum hastalığı salgını bildirilmiştir.
Mevcut bildirimdeki oğlaklarda etiyolojik olarak M. arginini ve Mannheimia haemolytica bir arada tespit edilmiştir. Pnömonilerin bakteriyel etkenleri arasında ilk sırada yer alan Mannheimia haemolytica genellikle 12 haftalıktan küçük kuzu ve oğlaklarda septisemik formda seyreder ve genellikle de solunum belirtileri bu formda çok dikkati çekmez. Pnömoni belirtileri daha çok yaşı büyük hayvanlarda dikkat çekicidir. M. arginini ve Mannheimia haemolytica'nın bir arada olmasının oğlaklarda şiddetli solunum belirtilerine neden olduğu düşünülmektedir.
Diğer türlerde olduğu gibi gebe keçilerin de gebeliğin son dönemlerinde pnömoniye neden olabilen etkenlere karşı aşılanmaları ile kolostrumda spesifik antikorların miktarı artırılabilir. Böylece oğlaklar doğumdan sonraki 6-8 hafta süresince pnömonilerden korunmuş olurlar. Mevcut bildirimde ölen oğlakların annelerine bu amaçla herhangi bir aşılamanın yapılmadığı bilgisi alınmış ve bu nedenle de 3-8 günlük ve pasif korunması olmadığı düşünülen oğlaklarda solunum hastalığının şiddetli olarak geliştiği düşünülmüştür.
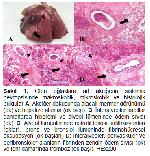
Keçilerin bulaşıcı plöropnömonilerinde enfekte akciğerlerin histopatolojik incelemesinde, sıklıkla akut serofibrinözden fibrino nekrotik plöropnömonilere, alveol boşluklarında, bronşiollerde, interstisyel septumda ve subplöral destek dokuda başlıca polimorf nükleer nötrofillere ve yangısal hücrelere rastlanabilir25,26. Bu araştırmada histopatolojik akciğer bulguları olarak, yukarıda bildirimi yapılan araştırmalardaki akciğer bulguları ile benzer şekilde fibrinli pnömoni bulguları gözlenmiştir.
Sonuç olarak, oğlaklar için M. arginini her ne kadar solunum sisteminin önemli bir patojeni olarak görülmese de, immun sistemi gelişmemiş ve pasif korunması olmayan oğlaklarda bakteriyel etkenlerle beraber önemli kayıplara neden olabilen solunum sistemi hastalığına yol açabileceği saptanmıştır. Klasik pastörelloziste Mannheimia haemolytica'nın bu yaş grubu oğlaklarda septisemik seyrettiği ve klasik pnömoni bulgularına neden olmadığı düşünüldüğünde ise bu bulguların oluşumunda M. arginini'nin etkisi ortaya çıkmaktadır. Sahada özellikle oğlaklarda bu yaş grubunda karşılaşılan solunum problemlerinde gerekli tedbirler alınırken mikoplazmal etkenlerin de dikkate alınması gerektiği sonucuna ulaşılmıştır.