Örnekleme: Çalışmada dışkı örneği toplanacak Burdur iline bağlı ilçeler, Holştayn sığır işletmeleri ve sağlıklı buzağılar tesadüfi örnekleme metodu ile seçildi. Dışkı örnekleri, 3 ilçeden (Bucak, Merkez ve Tefenni), toplam 44 işletme ziyaret edilerek her ilçeden 50şer adet olmak üzere toplam 150 adet Holştayn ırkı 6 aylık yaşta ve daha küçük olan sağlıklı buzağılardan toplandı. Çalışmadaki seçilen işletmelerin herbirinden en az 2 ve en fazla 5 buzağıdan dışkı örneği alındı. Ayrıca dışkı örneği toplanan buzağıların yaşları (ay) kaydedildi. Yaş dağılımına göre; 0 ≤2 ay yaş arası 56 buzağıdan, 2 ay < ≤4 ay yaş arası 47 buzağıdan ve 4 ay < ≤6 ay yaş arası 47 buzağıdan örnek toplandı. Dışkı örnekleri, steril dışkı numunesi alma kapları içerisine her bir hayvan için ayrı eldiven kullanılarak direkt rektumdan alındı. Numuneler alımı takiben soğuk şartlarda 2 saat içerisinde laboratuvara nakledildi.
Bu çalışma Mehmet Akif Ersoy Üniversitesi Hayvan Deneyleri Yerel Etik Kurulu tarafından 09.09.2015 tarih ve 139 sayılı kararı ile uygun bulunmuştur.
Ön Zenginleştirme ve Selektif İzolasyon: Alınan her bir dışkı örneğinden tamponlanmış peptonlu su (Lab M, İngiltere) içinde %10luk süspansiyon hazırlandı ve 37 °Cde aerobik koşullarda 24 saat süreyle inkübe edildi. Ardından her bir dışkı süspansiyonundan 25 μL alınıp içerisine 2 μg/ml sefotaksim (Sigma, ABD) veya 2 μg/mL seftazidim (Sigma, ABD) ilave edilerek hazırlanmış Brilliance E. coli / koliform selektif besi yerlerine (Oxoid, İngiltere) eş zamanlı olarak ekildi ve petriler 37 °Cde aerobik koşullarda 24 saat süreyle inkübasyona alındı. Petrilerde üreyen seftazidim ve sefotaksime dirençli mor renkli kolonilerden MacConkey Agar (BD, ABD) besi yerine pasajlar yapıldı ve 37 °Cde aerobik koşullarda 24 saat inkübe edildi. MacConkey Agar (BD, ABD) besiyerinde üreyen pembe renkli laktoz pozitif koloniler Tryptic Soy Agar (Oxoid, İngiltere) besi yerine pasajlandı ve 37 °Cde aerobik koşullarda 24 saat inkübe edildi.
E. coli İdentifikasyonu ve Genetik Doğrulama: E. coli identifikasyonu amacıyla üçlü tüp sistemi 12 ve ayrıca katalaz testi, metil red testi, oksidaz testi, sitrat testi ve Voges-Proskauer testi uygulandı 13. Elde edilen suşlardan DNA ekstraksiyonu kaynatma yöntemi ile yapıldı. Bunun için, Tryptic Soy Agar (Oxoid, ABD)da üretilmiş E. coli izolatlarının her birinin steril ultra saf su içinde süspansiyonları hazırlandı (McFarland 5.0) ve süspansiyonlar 99 °Cde 15 dakika termal blokta tutuldu. Ardından süspansiyonlar 14000 rpmde 5 dakika santrifüj edilip hücre partikülleri çöktürüldü. DNAnın olduğu üst sıvıdan 100 μL alınıp steril ependorf tüplere aktarıldı. İzolatlardan elde edilen bu DNA örnekleri ile E. coli 16S rRNA genine özel primer çifti (Thermo Fisher Scientific Inc) kullanılarak polimeraz zincir reaksiyonu (PZR) yapılıp izolatların genetik doğrulaması gerçekleştirildi 14. PZRde pozitif kontrol suşu olarak E. coli ATCC 25922 kullanıldı.
GSBL Fenotipik Doğrulama Testi (Kombine Disk Metodu): İdentifikasyonları gerçekleştirilen E. coli izolatlarının GSBL üreten izolatlar olup olmadığının tespiti amacıyla Klinik ve Laboratuvar Standartları Enstitüsü (Clinical and Laboratory Standards Institute, CLSI)nün önerdiği fenotipik doğrulama testi uygulandı 15. Test, 0.5 McFarlanda göre yoğunluğu hazırlanmış E. coli izolatı süspansiyonu ile Mueller Hinton Agar (BD, ABD) besi yerinde, sefotaksim (30 μg) (BD, ABD) ve sefotaksim-klavulanik asit (30/10 μg) (BD, ABD), seftazidim (30 μg) (BD, ABD) ve seftazidim-klavulanik asit (30/10 μg) (BD, ABD) diskleri kullanılarak gerçekleştirildi. Sefalosporin klavulanik asit kombinasyonunu içeren diskin etrafında oluşan inhibisyon zon çapı, aynı sefalosporin antibiyotiği içeren diskin etrafında oluşan zonun çapından 5 mm ve daha fazla ise, bu izolat GSBL üretimi açısından pozitif olarak kabul edildi 15. Testte, pozitif ve negatif kontrol suşları olarak sırasıyla Klebsiella pneumoniae ATCC 700603 ve E. coli ATCC 25922 kullanıldı 15.
Antimikrobiyel Duyarlılık Testi: GSBL üretimi doğrulanan E. coli izolatlarının beta laktam antibiyotiklere olan duyarlılıkları agar disk difüzyon testi ile belirlendi 15. Bu amaçla, aztreonam (30 μg), sefpodoksim (10 μg), seftriakson (30 μg), sefoksitin (30 μg) ve seftiofur (30 μg) diskleri (Oxoid, İngiltere) kullanıldı. Test Mueller Hinton Agar (BD, ABD)da gerçekleştirildi. Aztreonam, sefpodoksim ve seftriakson inhibisyon zon çapları CLSInin GSBL tarama testi zon çapları kriterlerine göre değerlendirildi 15. Sefoksitinin değerlendirilmesinde ise CLSInin Enterobactericeae familyası için standart zon çapları kullanıldı 15.
Elde edilen GSBL üreten E. coli izolatlarının, diğer sınıf antibiyotiklere olan duyarlılıkları CLSI protokolüne göre agar disk difüzyon testi ile Mueller Hinton Agar (BD, ABD)da belirlendi 15. Bu amaçla, enrofloksasin (5 μg), florfenikol (30 μg), gentamisin (10 μg), tetrasiklin (30 μg) ve sulfametoksazol - trimetoprim (25 μg) diskleri (Oxoid, İngiltere) kullanıldı. Enrofloksasin ve tetrasiklinin değerlendirilmesinde CLSInin hayvan patojenleri için önerdiği zon çapları baz alındı 16. Florfenikolün değerlendirilmesinde hayvan patojenleri Mannheimia haemolytica, Pasteurella multocida ve Histophilus somni için kabul edilmiş zon çapları baz alındı 17. Gentamisin ve sulfametoksazol trimetoprim inhibisyon zon çaplarının değerlendirilmesinde ise CLSInin hayvan patojenleri için güncellenmiş kritik zon çapları baz alındı 17.
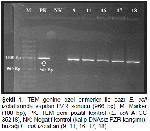
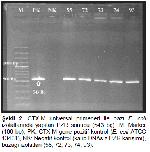
GSBL Genleri İçin PZR: DNA örneklerinin her biri, TEM 18,19, SHV 19,20 ve CTX-M 19,21 genlerine özel primerler (Thermo Fİsher Scientific Inc) kullanılarak PZR ile test edildi. CTX-M geninin belirlenmesi için önce üniversal primer 19,21 kullanılarak CTX-M geni taşıyan izolatlar belirlendi. Ardından CTX-M grup 1 primerleri ile CTX-M geni taşıyan izolatlara PZR yapıldı 19,22. PZRda pozitif kontrol izolatları olarak,TEM geni için E. coli ATCC 35218 (TEM-1), SHV geni için K. pneumoniae ATCC 700603 (SHV-18), CTX-M üniversal ve CTX-M grup 1 PZR için E. coli NTCC 13461 izolatları kullanıldı. Çalışmada uygulanan PZR protokolleri Pehlivanoglu ve ark. 11dan alındı. PZR ürünleri, %1lik agaroz jel içerisinde yürütülerek ultraviole ışığı altında görüntülendi.
İstatistiksel Analiz: Buzağıların yaş grupları arasında GSBL üreten E. coli taşıyıcılığı açısından farkın önemli olup olmadığının belirlenmesi amacıyla Pearson ki kare testi uygulandı 23. Değerlendirmede P<0.05 değeri istatistiksel olarak önemli kabul edildi.