Beta laktam antibiyotikler, hayvanlarda çeşitli bakteriyel hastalıkların (arthritis, ayak enfeksiyonu, enteritis, idrar yolu enfeksiyonları, mastitis, metritis, pnömoni, septisemi, vb.) tedavisinde, yan etkisi diğer antibiyotik gruplarına göre daha düşük olduğundan, yaygın olarak tercih edilmektedir. Ancak son yıllarda Gram negatiflerde görülen beta laktam grubu antibiyotiklere karşı direnç artışı, veteriner hekimlikte beta laktam antibiyotiklerin enfeksiyonların tedavisindeki değerini azaltmaya başlamıştır
1.
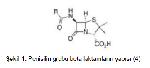
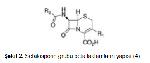
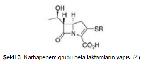
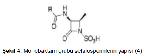
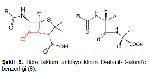
Beta laktam antibiyotikler penisilinler, sefalosporinler, monobaktamlar ve karbapenemler olmak üzere 4 gruba ayrılan bakteriyosidal etkili antimikrobiyellerdir 2. Yapılarında kendilerine özgü bir azot ve 3 karbon atomu içeren beta laktam halkası bulunmasından dolayı beta laktam antibiyotikler olarak adlandırılmışlardır. Monobaktam grubu hariç diğerlerinde beta laktam halkasına bitişik beş veya altı üyeli bir başka halka daha bulunmaktadır (Şekil 1-4) (3, 4).
Beta laktam antibiyotiklerin Gram negatif bakteriler üzerine etki mekanizmasını anlamak için öncelikle bakteri hücre duvarı sentezini ve yapısını bilmek gerekmektedir. Gram negatif bakterilerde hücre duvarı temel olarak peptidoglikan tabaka ve dış membran yapılarından oluşmaktadır 5 (Şekil 5).
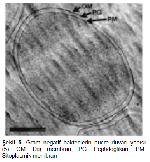
Büyütmek İçin Tıklayın |
Şekil 5: Gram negatif bakterilerin hücre duvarı yapısı 5. OM: Dış membran, PG: Peptidoglikan, PM: Sitoplasmik membran |
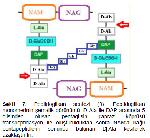
Gram negatif bakteri hücre duvarında, kompleks bir yapı olan peptidoglikan tabakası (murein) bulunmaktadır. Peptidoglikanın glikan kısmı, N-asetilmuramik asit (NAM) ve N-asetil glukozamin (NAG) moleküllerinin ardışık sıra beta-1,4 glikozid bağları ile birbirine bağlanmasıyla oluşturduğu zincirlerden oluşmaktadır. Ayrıca, NAM molekülüne bağlı kısa peptid zincirleri (4 amino asitlik: Lalanin D isoglutamin (D-glutamik asit) Diaminopimelik asit Dalanin) vardır ve bitişik glikan zincirlerinin NAM moleküllerindeki bu kısa peptidler arasında çapraz bağlar (pentaglisin köprüleri) bulunur (Şekil 6). Bu görünümü ile peptidoglikan tabaka bakteriyi saran bir kafese benzer ve hücre duvarının sağlamlığını sağlar 6-8.
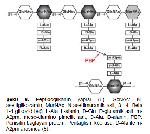
Büyütmek İçin Tıklayın |
Şekil 6. Peptidoglikanın yapısı 8. GcNAc: N-asetilglikozamin; MurNAc: N-asetilmuramik asit; β1-4: Beta 1-4 glikozid bağ; L-Ala: L-alanin; D-Glu: D-glutamik asit, m-A2pm: meso-diamino pimelik asit; D-Ala: D-alanin; PBP: Penisilin bağlayan protein; Pentaglisin köprüsü: D-Ala ile m-A2pm arasında 8. |
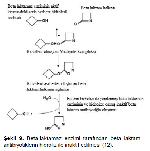
Peptidoglikan sentezinde ilk aşama üridin difosfo (UDP)-NAG ve UDP-NAMın sentezlenmesidir. Ardından pentapeptidi oluşturan (L-alanin-D-isoglutamin- Diaminopimelik asit-D-alanin-D-alanin) amino asitler, farklı enzimler, ATP ve Mn+2 veya Mg+2 katyonları aracılığıyla UDP-NAMın karboksil grubuna tek tek eklenir. Fakat son iki amino asit bir dipeptid olarak (D-alanin-D-alanin) eklenir. Bakterinin sitoplasmik membranının iç yüzünde oluşturulan bu yapılar hücre membranındaki baktoprenol olarak adlandırılan bir lipid taşıyıcıya aktarılır. Bu taşıyıcı vasıtasıyla periplasmik boşluğa geçerler ve taşıyıcıdan ayrılıp peptidoglikan omurgaya aktarılırlar (translokasyon). Ancak başlangıçta yeni oluşan peptidoglikan polimerleri diğer peptidoglikan zincirleri ile çapraz bağ oluşturmamış D-Ala-D-Ala COOH grubu taşıyan pentapeptid molekülleri içerirler. Bu aşamada transpeptidasyon ile peptidoglikan zincirleri arasında peptid köprüleri (pentaglisin) oluşturulur ve aynı zamanda uçtaki D-alanin peptid zincirinden ayrılarak uzaklaştırılır (Şekil 7) 7-9.
Büyütmek İçin Tıklayın |
Şekil 7: Peptidoglikan sentezi 9. Peptidoglikan monomerinin şematik görünümü. D-Ala ile DAP arasında 5 glisinden oluşan pentaglisin çapraz köprüsü transpeptidasyon ile oluşturulduktan sonra NAMa bağlı pentapeptidlerin sonunda bulunan D-Ala kesilerek uzaklaştırılır. |
Yukarıda bahsedilen transpeptidasyon aşamasında rol oynayan enzimler penisilin bağlayıcı proteinler (PBP) olarakta adlandırılmaktadır. PBPler biri sitoplazmik membrana gömülü diğeri periplasmik aralığa uzanan 2 kısımdan oluşur. Beta laktam antibiyotikler, NAMA-pentapeptid ünitesinin son kısmında bulunan D-alanin-D-alanin dipeptidine yapısal olarak benzerlik gösterdiklerinden (Şekil 8), PBPler yanlış bir şekilde hücre duvarı sentezinde substrat olarak beta laktam antibiyotiğe bağlanırlar. Böylece, beta laktam antibiyotik ikiye bölünmekte olan bakteride transpeptidasyonda görev alan PBPlerin serin aktif kısmına kovalent olarak bağlanır ve enzimin (PBP) aktif bölgesi açillenir. Açillenmiş PBP beta laktamı hidrolize edemez ve transpeptidasyon işlemi gerçekleşemez. Bu beta laktam antibiyotiklerin etki mekanizmasını oluşturur. Böylelikle hücre duvarı sentezi durur ve otolitik enzimlerle hücre duvarı geçirgenliği artar. Bakteri hücresine çok miktarda sıvı girip sonunda lizis gerçekleşir 1,3,7,8.
Gram negatif bakterilerin beta laktamların öldürücü etkisinden korunmada kullandıkları 4 temel yol vardır. Bunlar, beta laktamları hidrolize eden beta-laktamaz enzimi üretmeleri, penisilin bağlayan proteinlerde (PBP) değişiklik yapması, effluks pompa sistemi ile beta laktam antibiyotiğin bakteri dışına atılması ve dış membran proteinlerinin sayısının azaltılması (porin proteinleri) şeklinde sıralanabilir 3,10.
Beta-laktamaz enzimleri, antibiyotiğin beta laktam halkasını hidrolize uğratan ve böylece antibiyotiğin hedefine (PBP) ulaşmadan önce inaktif olmasına neden olan enzimlerdir. Beta-laktamazlar, PBPler ile yapısal benzerlik gösterirler. Amino asit dizi benzerliğinden dolayı beta-laktamazlar ve PBPlerin ortak atadan köken aldıkları kabul edilmektedir. Bu durum, beta-laktamaz enziminin antibiyotiğe bağlanmasına, asile etmesine ve su molekülünü kullanarak hidrolize edip sonuç olarak antibiyotiği inaktif etmesine neden olur 3,11. Beta-laktamaz tarafından antibiyotiğin inaktif edilmesi sırasıyla asilasyon ve deasilasyon aşamalarında gerçekleşir 12.
Beta-laktamaz enziminin aktif kısmına beta laktam antibiyotiği bağlandıktan sonra kovalent olmayan bir kompleks şekillenir. Bu aşama geri dönüşümlüdür (reversible). Enzimin aktif kısmındaki serin radikali antibiyotiğin karbonil (carbonyl) kısmına bir nükleofilik atak gerçekleştirerek yüksek enerjili bir tetrahedral asilasyon ara maddesi oluşturur. Beta laktam nitrojenin protonasyonu ve C-N bağının kopması sonu beta laktam halkası açılır ve ara madde düşük enerjili kovalent asilenzim kompleksine dönüşür. Ardından aktif olmuş su molekülü kovalent komplekse saldırır ve yüksek enerjili tetrahedral deasilasyon ara maddesi meydana gelir. Beta laktam karbonil grubu ile serinin oksijeni arasındaki bağın hidrolizasyonu gerçekleşir ve sonuçta inaktif beta laktam antibiyotiği serbest kalırken tamamıyla aktif beta laktamaz enzimi de yenilenmiş olarak serbest kalır 12,13 (Şekil 9).
Büyütmek İçin Tıklayın |
Şekil 9: Beta-laktamaz enzimi tarafından beta laktam antibiyotiklerin hidroliz ile inaktif edilmesi 12. |
Beta-laktamaz enzimi ile beta laktam antibiyotiklere direnç kazanma, Gram negatiflerin kullandığı en yaygın direnç mekanizmasıdır 14. Beta-laktamaz enzimleri Gram negatif bakterilerde hem konstitutif hem de antibiyotik varlığında indüklenebilir nitelikte üretilir ve periplasmik aralık içinde bulundurulur 15.
Gram Negatif Bakterilerin Beta-laktamaz Enzimleri
Beta-laktamazlar, yüksek düzeyde heterojenlik gösteren enzim grubudur 16. Bugün itibariyle tanımlanmış 4300den fazla beta-laktamaz enzimi vardır 17. Beta laktamazların amino asit dizilerinin çeşitlilik göstermesine rağmen tümünün ortak bir topolojiye sahip olduğu da bilinmektedir 18.
Beta-laktamazlar farklı şekillerde sınıflandırılırlar. Aşağıda günümüzde en yaygın kullanılan Bush-Jacoby ve Medeiros tarafından yapılan fonksiyonel sınıflandırma ve Ambler tarafından yapılan moleküler sınıflandırma sunulmuştur 19.
Beta-laktamazları kodlayan genler (bla), bakteri kromozomu, plasmidleri ve transpozonları üzerinde bulunmaktadırlar. Beta-laktamaz genlerinin yer değiştirebilir genetik elementler üzerinde bulunması, kolaylıkla bakteriler arasında transfer olmalarını sağlamaktadır. Son yıllarda, beta-laktamaz genlerinin integronlar üzerinde çoklu antibiyotik dirençliliği kasetlerinin bir parçası olarak bulunduğu da belirlenmiştir 3,10. İntegronlar yer değiştiren genetik elementler değildir. Bir integron, bir 5 korunmuş integraz geni (int), üzerinde diğer antibiyotik dirençlilik genlerinin bulunduğu bir gen kaseti ve gen kasetinin integrasyon yerini (attI) içerir. Beta-laktamaz genlerini taşıyan integronları bulunduran transpozon ve plazmidler, böylece bla genlerinin kolaylıkla yayılmasını sağlarlar 3.
Ambler Moleküler Sınıflandırma
Ambler moleküler sınıflandırma sistemi, beta-laktamazların amino asit dizisindeki benzerlikleri temel almıştır. Ambler sınıflandırma sisteminde, beta-laktamazlar A, B, C ve D olarak kodlanan 4 ana sınıfa ayrılmışlardır. A, C ve D sınıflarındaki enzimlerin aktif kısımlarında serin bulunduğu için serin beta-laktamazlar olarak bilinirler. B sınıfı ise metallo-beta-laktamazlardır ve aktif kısımlarında çinko (Zn2+) bulunmaktadır. Ayrıca, bu gruplardaki beta-laktamazlar arasında enzim hidrolitik mekanizmaları açısından da farklılıklar vardır. Serin beta-laktamazlar PBPlere benzerlik gösterirler ve her ikisi Ser-Xaa-Xaa-Lys motifi taşırlar. Her ikiside serini nükleofilik reaksiyonda kullanır ve bir kovalent asilenzim ara maddesi ile beta laktam antibiyotikleri hidrolize eder. Metallo-beta-laktamazlar ise metal merkezi oluşturan His-Xaa-His-Xaa-Asp motifi ile farklılık gösterirler. Metallo-beta-laktamazlar ise hidrolizde metal ile aktive olmuş su nükleofilini kullanır 2.
Sınıf A Beta-laktamazlar
Bu sınıf, kromozomal ve plasmid kökenli penisilinazları, sefalosporinazları ve karbapenemazları kapsamaktadır. Bush-Jacoby-Medeiros sınıflandırma sisteminde grup 2de yer alırlar. Sınıf A beta laktamazların temel özellikleri aşağıda sunulmuştur 12.
1-Penisilinazlar (PC1): Benzilpenisilini sefalosporinlerden daha iyi hidrolize ederler. Klavulanik asit ile inhibe olurlar. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2a grubundadırlar. PC1, bu grubun temsilcisi enzimdir.
2-Penisilinazlar ve ilk sefaloporinazlar: Penisilinleri ve sefalosporinleri hidrolize eden ve klavulanik asit tarafından inhibe edilen enzimlerdir. Bu grubu temsil eden enzimler TEM-1 (Temoneira), TEM-2 ve SHV-1 (sulfhydryl variant)dir. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2b grubundadırlar.
3-Genişlemiş spektrumlu beta-laktamazlar (GSBL): Oksiimino beta laktamları ve monobaktamları hidrolize eden ve klavulanik asit tarafından inhibe edilen enzimlerdir. SHV-2, TEM-3, CTX-M-15 (cefotaximase), PER-1 ve VEB-1 bu grubu temsil eden enzimlerdir. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2be grubundadırlar.
TEM, SHV ve CTX-M tipi beta-laktamazlar Gram negatiflerde, özellikle Enterobactericeae familyası bakterilerde, üretilen en yaygın GSBLlardır. TEM tipi beta- laktamazlar TEM-1 ve TEM-2nin türevleri, SHV tipi beta-laktamazlar ise SHV-1 in türevleridir 14,16. Tüm TEM ve SHV tipi GSBLlar, bahsedilen genlerde şekillenen nokta mutasyonlar sonucu, tek aminoasit değişiklikleri ile şekillenmişlerdir ve rakamlar verilerek yeni enzimler kodlanmışlardır (TEM-3, TEM-4 ve diğerleri; SHV-3, SHV-4, ve diğerleri) 18,20. Son 10 yıl içinde hızlı bir artış gösteren sefotaksim dirençli Gram negatif bakterilerde bulunan CTX-M tipi beta-laktamazlar ise TEM ve SHV tipi beta-laktamazlardan köken almazlar ve bu enzimler, her biri çok sayıda alt tip içeren CTX-M-grup 1, grup 2, grup 8, grup 9 ve grup 25 olarak adlandırılmış 5 gruptan oluşmaktadır 14,18,20.
TEM, SHV ve CTX-M tip beta-laktamazlar fenotipik olarak çok belirgin olmayan farklılıklar gösterebilmektedirler. Örneğin, CTX-M enzimleri, sefotaksimi seftazidime göre daha iyi hidrolize edebilmekte iken klavulanik asite kıyasla tazobaktam tarafından daha iyi inhibe edilmektedir (Tablo 1) 14,18.
4- Penisilinazlar: klavulanik asit, tazobaktam ve sulbaktam tarafından inhibe edilmeye dirençli penisilinazlardır. TEM-30 ve SHV-10, bu grubu temsil ederler. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2br grubunda bulunurlar.
5- Genişlemiş spektrumlu sefalosporinazlar: Klavulanik asit, tazobaktam ve sulbaktam tarafından inaktif olmaya dirençli olan genişlemiş spektrumlu sefalosporinleri ve monobaktamları hidrolize edebilen enzimlerdir. TEM-50, bu grubun temsilcisidir. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2ber grubunda bulunurlar.
6-Genişlemiş spektrumlu sefalosporinazlar: Sefalosporinleri hidrolize uğratan ancak aztreonamı hidrolize edemeyen, klavulanik asit tarafından inaktif edilebilen enzimlerdir. CepA, bu grubu temsil eden enzimdir. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2e grubunda bulunurlar.
7-Karbenisilinazlar: Karbenisilini hidrolize eden ve klavulanik asite duyarlı olan enzimlerdir. PSE-1 ve CARB-3, bu grubu temsil eden enzimlerdir. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2c grubundadırlar.
8-Karbenisilinazlar: Karbenisiline ek sefepim ve sefpiromuda hidrolize eden ve klavulanik asit tarafından inhibe edilen enzimlerdir. RTG-4, bu grubun enzimidir. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2ce grubundadırlar.
9-Karbapenemazlar: Oksiimino beta laktamları, sefamisinleri ve karbapenemleri hidrolize eden enzimlerdir. Klavulanik asite duyarlılığı değişkendir. Bu enzimler sıklıkla Enterobacter cloacae, Serretia marcescens ve Klebsiella pneumoniaede belirlenirler. KPC-2 (Klebsiella pneumonae carbapenemase), IMI-1 ve SME-1 enzimleri bu grupta yer alır. Bush-Jacoby-Medeiros sınıflandırma sisteminde 2f grubundadırlar.
Sınıf B Beta-laktamazlar
Bu sınıftaki beta-laktamazlar yapısal özelliklerine göre 3 alt sınıfa ayrılırlar. 21,22.
Alt Sınıf B1: Penisilinleri, sefalosporinleri ve karbapenemleri hidrolize uğratırlar fakat monobaktamları hidrolize edemezler. Beta-laktamaz inhibitörleri tarafından ise inhibe edilemezler (IMP-1, VIM-1, CcrA, IND-1). Bush-Jacoby-Medeiros sınıflandırma sisteminde 3a alt grubuna denk gelirler 12,22.
Alt Sınıf B2: Karbapenemleri penisilin ve sefalosporinlere göre daha iyi hidrolize edebilirler. Beta-laktamaz inhibitörleri tarafından ise inhibe edilemezler (CphA, Sfh-1). Bush-Jacoby-Medeiros sınıflandırma sisteminde 3b grubuna denk gelirler 12,22.
Alt Sınıf B3: Bu alt gruptaki enzimler (L1, CAU-1, GOB-1, FEZ-1), diğer enzimlerden çinko iyonu bağlanmasında görev alan amino asitlerin farklı olmasıyla ayrılsa da, benzer geniş spektrum substrat profillerine sahiptirler. Bush-Jacoby-Medeiros sınıflandırma sisteminde 3a alt grubu altında sınıflandırılmışlardır 22.
Sınıf C Beta-laktamazlar
Bu sınıftaki enzimler, AmpC beta-laktamazlar olarak da bilinirler. Çoğunlukla kromozomlarda bulunan genler tarafından kodlanmalarına rağmen plasmidlerde bulunan AmpC beta-laktamaz genleride vardır. AmpC beta-laktamaz üreten bakteri, penisilinlere, sefalosporinlere (oksiimino-sefalosporinler dahil) ve sefamisinlere dirençlidirler. Beta-laktamaz inhibitörleri tarafından inhibe edilemezler ancak kloksasilin ve 3-aminofenilboronik asit tarafından inhibe edilirler 12,18,23,24. Kromozomlarda bulunan AmpC genleri normal şartlarda eksprese olmazlar ancak bu genlerde derepresyona neden olan mutasyon oluşumu veya beta laktam antibiyotik varlığında indüklenme sonrasında yüksek seviyede eksprese olurlar. Plasmidlerde bulunan AmpC beta-laktamaz genleri ise temel olarak 6 familyaya ayrılmış olup ACC, CIT, DHA, EBC, FOX ve MOX olarak kodlanmışlardır 23,24. Plasmid kökenli AmpC beta-laktamaz genleri ise indüklenebilir nitelikte değildir ve kromozomal genlerin transferi ile gelişmişlerdir 25.
Bush-Jacoby-Medeiros sınıflandırmasında, grup 1de yer alırlar ve ayrıca kendi içinde alt grup 1 ve grup 1e diye 2ye ayrılırlar. Alt grup 1e, grup 1in türevleridir ve amino asit değişiklikleri, ilavesi ve çıkarılması ile türemişlerdir 22,23.
Sınıf D Beta-laktamazlar
Bu sınıftaki beta-laktamazlar, oksasilini hidrolize ettiklerinden dolayı OXA tipi beta-laktamazlar olarak adlandırılmışlardır. OXA beta-laktamazlar, beta-laktamaz enzimleri arasında en fazla çeşitlilik gösteren gruptur. OXA tipi beta-laktamazların (OXA-11 ve OXA-15) bir kısmı, GSBL aktivitesi gösterir ve oksiimino sefalosporinlere direnç gelişimine neden olur. Karbapenemleri hidrolize edebilen OXA tipi beta-laktamazlarda (karbapenemaz) (OXA-23 ve OXA-48) mevcuttur ve sınıf Dye dahil edilmişlerdir 12,18. Bush-Jacoby-Medeiros sınıflandırma sisteminde grup 2d, 2de ve 2dfde yer almaktadırlar 21,22.
Bush-Jacoby ve Medeiros Sınıflandırması
Beta-laktamazlar, Bush Jacoby Medeiros sınıflandırma sisteminde, substrat ve inhibitör profillerine göre 4 ana gruba ayrılmıştır ve grup 1, grup 2, grup 3 ve grup 4 olarak adlandırılmışlardır.. Ancak, Bush ve Jacoby sınıflandırma sistemi 2009 yılında güncellenmiş olup grup 4 sınıflandırılmadan çıkarılmıştır 22. Bush-Jacoby sınıflandırması ayrıca beta-laktamazları çok sayıda alt gruba (alt grup 1, 1e, 2a, 2b, 2be, 2br, 2ber, 2c, 2ce, 2d, 2de, 2df, 2e, 2f, 3a ve 3b) ayırmaktadır 19,21,22. Tablo 1de bu sınıflandırmadaki grupların substrat, inhibitör ve enzim karakteristikleri sunulmuştur 22.
En son sınıflandırma bu iki sınıflandırma yönteminin kombinasyonundan oluşmaktadır ve beta-laktamazların büyük çoğunluğunu 17 grupta toplamaktadır. Bu son sınıflandırmada ayrıca inhibitör olarak avibaktam (AV) maddesi de serin beta-laktamazların ve metallo-beta-laktamazların ayrımında kullanılmıştır ve tüm fenotipik testlerde ayrımı yapabildiği belirlenmiştir 26. Aşağıda Şekil 10da bu son sınıflandırma sunulmuştur 26.
Her geçen gün DNA dizi analizinin kolaylığı ve yaygınlaşmasında dolayı yeni beta- laktamazlar tanımlanmaktadır ancak yeni belirlenen enzimlerin bazıları tanımlanmış grupların belirli fenotipik özelliklerini taşımadıklarından sınıflandırılmalarında zorluk yaşanabilmektedir.
Beta-laktamaz Veri Tabanı
Günümüze kadar tespit edilmiş olan bakteriyel beta-laktamazlar hakkındaki bilgilere beta-laktamaz veri tabanından ulaşılabilmektedir. Bu veri tabanı http://bldb.eu/ internet sitesinde bulunmaktadır 17. Bu veri tabanı, antibiyotik dirençliliğinde öneme sahip beta- laktamazların nükleotid ve amino asit dizileri, fonksiyonları ve yapıları hakkında bilgileri içermektedir. Bu veri tabanına erişim ücretsiz olarak mümkündür.
Türkiyedeki Durum
Türkiyede sağlıklı ve hasta hayvanlardan izole edilmiş Gram negatiflerin ürettikleri beta-laktamazların belirlenmesine yönelik çalışmalar, son beş yıl içerisinde yoğunluk kazanmıştır. Ancak bu çalışmaların bir kısmında beta-laktamaz enzimlerinin dizi analizi ile karakterizasyonu yapılmış olup diğerlerinde polimeraz zincir reaksiyonu (PCR) düzeyinde genlerin belirlenmesi ile çalışma bulguları sınırlı kalmıştır. Ayrıca Türkiyedeki çalışmalar genişlemiş spektrumlu beta-laktamazlar (TEM, SHV, CTX-M and OXA)(Ambler moleküler sınıf A ve D, Bush-Jacoby ve Medeiros Sınıflandırması grup 2) ve AmpC tip beta- laktamazlar (Ambler moleküler sınıf C, Bush-Jacoby ve Medeiros Sınıflandırması grup 1) ve özellikle E. coli üzerine odaklanmış durumdadır. Bunun da nedeni Gram negatif bakterilerde en yaygın olarak bu beta-laktamazların üretilmekte olduğunun bilinmesidir. Tablo 2de Türkiyede evcil ve çiftlik hayvanlarında yapılmış çalışmaların bulguları sunulmuştur.