Bazı amino asitlerin arginaz enzimini inhibe ettiği araştırmacılar tarafından ortaya koyulmuştur. Bu amino asitlerden ornitin, sistein, lizin, lösin, izolösin
3, 10, 14, 15, prolin
3, 14, hidroxiprolin, homoarginin
2 inhibisyon etkileri saptanmıştır.
Muszynska ve Wojtczak 16, amino asitlerin ligand olduğunu, bu ligandın arginaza bağlanmasıyla enzimi konformasyonel değişime uğrattığı ve bununda enzim-substrat komplexinin turnover'ını bozduğunu belirtmişlerdir.
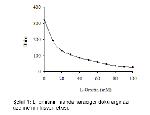
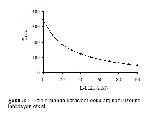
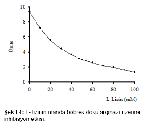
Yaptığımız bu çalışmada, manda karaciğer ve böbrek doku arginazı üzerine farklı konsantrasyonlarda L- ornitin ve L- lizinin etkisini araştırmak amacıyla 20 mM L- ornitin ilave edildiğinde karaciğer doku arginazını %60, böbrek doku arginazını %39 inhibe ederken 20 mM L-lizin ise karaciğer doku arginazını %47, böbrek doku arginazını %41 oranında inhibe etmiştir. İnhibitörlerin konsantrasyonu 80 mM'a çıkarıldığında L- ornitinin karaciğer doku arginazını %89, böbrek doku arginazını %86 inhibe ederken; L- lizin ise karaciğer doku arginazını %81, böbrek doku arginazını %79'luk bir inhibisyonuna uğrattığı görülmüştür (Şekil 1, 2, 3, 4). Bu sonuçlara göre, L- ornitinin manda karaciğer ve böbrek dokusunu, L-lizinden daha kuvvetli inhibe ettiğini açıklayabiliriz. Bu sonuçlar Freedland ve ark. 15'nın yaptığı çalışma ile paralellik göstermiştir. L- lizin ve L- ornitin amino asitlerinin arginaz enzimi için kuvvetli inhibitörleri olduğu çeşitli çalışmalarla açıklanmıştır 3, 10, 14, 15, 17-21.
Sığır karaciğer arginazında yapılan bir çalışmada, kompetatif inhibitör etki yapan L-lizin ve L- ornitinin; putresin ve kadaverinden daha güçlü olduğunu açıklamışlardır 17. Bazı amino asitlerin rat meme bezi arginazında inhibisyon etkisi araştırılarak lizin, ornitin, valinin kuvvetli bir şekilde kompetatif tipte inhibisyona neden olduğunu; prolin, izolösin ve lösinin ise daha az inhibe ettiğini bulmuşlardır 18.
Amino asitlerin dokulara göre farklı etki ettiği de saptanmıştır. Özellikle bazı amino asitler karaciğer için bazıları ise böbrek için güçlü inhibitör etki yapmaktadır. Lizin ve ornitinin manda karaciğer ve böbrek doku arginazı üzerine güçlü inhibitör etkisi görülmüştür. Bazı çalışmalarla bu etki desteklenmiştir. Kaysen ve Strecker 19, canavanin ve homoargininin karaciğer arginazını inhibisyona uğratırken; homosistein, lizin, ornitin, prolinin ise böbrek arginazını güçlü bir şekilde inhibe ettiği ve bu amino asitlerin enzim üzerinde ikinci bir bölgeye bağlanarak etki ettiklerini açıklamışlardır. Levillain ve ark. 20 ise ördek böbrek tubulllerinin farklı kısımlarında lizin, prolin, ornitin ve glutaminin inhibisyon etkisini araştırmışlardır. Buna göre böbrek tubuluslarının büyük kısmında arginaz enzimini en kuvvetli inhibe eden amino asitin lizin olduğunu; daha sonra ornitin ve glutamin takip ettiği; prolinin ise inhibisyon gücünün istatistik önemi olmadığını açıklamışlardır.
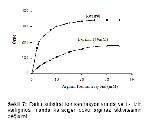
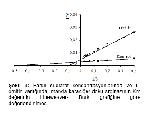
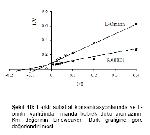
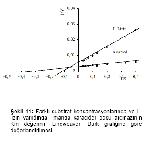
Bu çalışmada, L- ornitin ve L- lizinin manda karaciğer ve böbrek doku arginazında nasıl bir inhibisyona neden olduğu da saptanmıştır (Şekil 5, 6, 7, 8). Sonuçlara göre dokuların kontrollerin Km'leri, amino asit varlığındaki Km'lerinden farklı bulunmuştur. Kontrol Km'ler, karaciğer dokusu için 2,4 mM iken böbrek için 8 mM bulunmuştur. L- ornitin için karaciğerin 8,3 mM, böbreğin 14 mM bulunmasına karşılık L- lizin ilave edildiğinde karaciğerde 9,1 mM, böbrekte 13 mM olarak tespit edilmiştir. Farklı Km'lerin yanında Vmax değerlerinde de farklılık görülmüştür. Böylece manda karaciğer ve böbrek doku arginazlarının L- ornitin ve L- lizin ile karışık tipte inhibe ettiği tespit edilmiştir (Şekil 9, 10, 11, 12).

Büyütmek İçin Tıklayın |
Şekil 5: Farklı substrat konsantrasyonlarında ve L- ornitinin varlığında manda karaciğer doku arginaz aktivitesinin değişimi. |
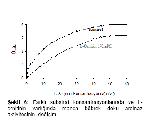
Büyütmek İçin Tıklayın |
Şekil 6: Farklı substrat konsantrasyonlarında ve L- ornitinin varlığında manda böbrek doku arginaz aktivitesinin değişimi. |
Büyütmek İçin Tıklayın |
Şekil 7: Farklı substrat konsantrasyonlarında ve L- lizin varlığında manda karaciğer doku arginaz aktivitesinin değişimi. |

Büyütmek İçin Tıklayın |
Şekil 8: Farklı substrat konsantrasyonlarında ve L- lizin varlığında manda böbrek doku arginaz aktivitesinin değişimi. |
Büyütmek İçin Tıklayın |
Şekil 9: Farklı substrat konsantrasyonlarında ve L- ornitin varlığında manda karaciğer doku arginazının Km değerinin Lineweaver- Burk grafiğine göre değerlendirilmesi. |
Büyütmek İçin Tıklayın |
Şekil 10: Farklı substrat konsantrasyonlarında ve L- ornitin varlığında manda böbrek doku arginazının Km değerinin Lineweaver- Burk grafiğine göre değerlendirilmesi. |
Büyütmek İçin Tıklayın |
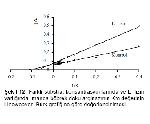
Şekil 11: Farklı substrat konsantrasyonlarında ve L- lizin varlığında manda karaciğer doku arginazının Km değerinin Lineweaver- Burk grafiğine göre değerlendirilmesi. |
Büyütmek İçin Tıklayın |
Şekil 12: Farklı substrat konsantrasyonlarında ve L- lizin varlığında manda böbrek doku arginazının Km değerinin Lineweaver- Burk grafiğine göre değerlendirilmesi. |
Rat karaciğer arginazında yapılan bir çalışmada ornitin ve üre kullanıldığında enzimi karışık inhibisyona uğrattığı açıklanmıştır 21.
Yapılan bazı çalışmalarda, L- ornitinin memeli karaciğer arginazı üzerindeki inhibitör etkileri araştırılmış farklı sonuçlar elde edilmiştir. Hunter ve Downs 22 yaptığı çalışmada, memeli arginaz enzimini kompetatif inhibe ederken Mora ve ark. 23 ise nonkompetatif olduğunu bulmuşlardır. L- ornitinin farklı derecelerde saflaştırılan renal hepatik arginazının kısmi olarak kompetatif / nonkompetatif (karışık tipte inhibisyon) etki yaptığı tespit edilmiştir 24. Pace ve Landers 25, saflaştırılmış sığır karaciğer arginazını pH değeri 9,5'da L-ornitinin kompetatif inhibe ettiğini bulmuşlardır.
İzole edilen rat karaciğer mitokondri arginazını ornitin ve lizinin inhibe ettiği saptanmıştır 15. Üre döngüsü enzimlerinden arginazı en iyi inhibe eden amino asitin lizin olduğunu ve enzimi karışık inhibe ederken 26, Subrahmanyam ve Reddy 17, lizin ve ornitinin sığır karaciğer enzimi için kuvvetli inhibitörü olduğunu kanıtlayarak enzimi kompetatif olarak inhibe ettiğini ortaya koymuşlardır. Sıçan karaciğer arginazını L- amino asitlerden ornitin ve lizinin kompetatif, valin, lösin, izolösin ve sisteinin ise nonkompetatif tipte inhibisyona uğrattığı belirtilmiştir 16
Dolinska ve Albrecht 27, rat beyin mitokondrisinde yaptıkları bir çalışmada 25 mM L-arginin kullanılarak L-ornitin ve L-lizinin etkisini açıklamışlardır. Buna göre enzimi 20 kat inhibe ettiği bulunmuştur. Carvajal ve ark. 28, insan karaciğer arginazının ornitinin nonkompetatif, lizinin ise kompetatif inhibitörü 20, 28 olduğunu açıklamışlardır.
Kaysen ve Strecker 19, rat böbreğinde yaptığı bir çalışmada arginaz enzimin allosterik bölgelerinin var olduğu açıklamışlardır. Ayrıca dallanmış zincirli amino asitler tarafından oluşturulan kısmi inhibisyonlar arginaz üzerinde allosterik bir bölgenin varlığını, inhibitörün bu bölgeye bağlandığını (non- kompetatif inhibisyon) ve enzim amino asit komplexinin enzimatik olarak aktif olduğunu göstermişlerdir 3. Rao ve ark. 29 meme tümörlerinde prolinin meme tümör arginazı üzerinde inhibisyon etkisini prolinin herhangi bir konformasyonel değişim olmaksızın aktif bölge için direkt olarak yarışmayla olduğunu açıklamışlardır.
L- lizinin 6-14 yaş arasındaki çocuklara 0,5 mmol/kg oranında enjeksiyonundan sonra plazmada ornitin ve arginin, idrarda ise amonyak konsantrasyonunda artışın saptanması, arginaz enzimini inhibe ettiğinin göstergesi olarak açıklanmıştır. Plazmadaki bu ornitin miktarındaki artış mitokondrial ornitin transportunun inhibisyonundan kaynaklandığı açıklanmıştır. Çünkü lizinin ammonojenik özelliğinin yanında hem ornitin transkarbamilaz aktivitesinin hemde lizin tarafından mitokondrial ornitin alınımının inhibisyonuyla ornitinin sitrüline dönüşümünü bozmasına neden olabileceği sonucuna varılmıştır 30.
Sonuç olarak, L- ornitin ve L- lizinin manda karaciğer ve böbrek doku arginazını inhibisyona uğrattığı saptanmış, inhibisyon tipinin ise karışık tipte (kompetatif-
nonkompetatif inhibisyon) olduğu ortaya konulmuştur.